
分析 (1)同温同压下,同体积的氢气和气体A的物质的量相等,根据n=$\frac{m}{M}$计算氢气物质的量,再根据M=$\frac{m}{n}$计算A的摩尔质量,根据N=nNA计算气体A的分子数,
同温同压下,同体积的氨气(NH3) 和硫化氢 (H2S)的物质的量相等,结合m=nM计算二者质量之比,根据n=$\frac{m}{M}$计算同质量的氨气和硫化氢气体的物质的量之比,相同条件下气体的体积之比等于其物质的量之比,结合每个分子含H原子数目计算同质量的氨气和硫化氢气体含有的氢原子个数比;
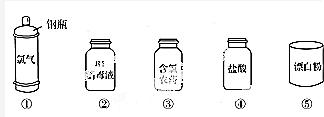
(2)溶液配制一般步骤为:计算、量取、稀释、恢复室温、移液、洗涤、加水定容、摇匀、转移试剂瓶中贴标签;
稀释前后溶质硫酸的物质的量不变,据此计算需要浓硫酸的体积.
解答 解:(1)0.2g氢气物质的量为$\frac{0.2g}{2g/mol}$=0.1mol,同温同压下,同体积的氢气和气体A的物质的量相等,则则气体A的摩尔质量为$\frac{3.4g}{0.1mol}$=34g/mol,A的分子数为0.1mol×6.02×1023mol-1=6.02×1022;
同温同压下,同体积的氨气(NH3) 和硫化氢 (H2S)的物质的量相等,结合m=nM可知,二者质量之比为17g/mol:34g/mol=1:2,根据n=$\frac{m}{M}$可知同质量的氨气和硫化氢气体的物质的量之比为34g/mol:17g/mol=2:1,则相同条件下同质量的氨气和硫化氢气体的体积比为2:1,含有的氢原子个数比为2×3:1×2=3:1,
故答案为:34g/mol;6.02×1022;1:2;2:1;3:1;
(2)溶液配制一般步骤为:计算、量取、稀释、恢复室温、移液、洗涤、加水定容、摇匀、转移试剂瓶中贴标签,所以正确的操作顺序为:①③②④⑥⑤,
稀释前后溶质硫酸的物质的量不变,则需要浓硫酸的体积为$\frac{100mL×1.5mol/L}{18mol/L}$=8.3mL,
故答案为:8.3.
故答案为:①③②④⑥⑤;8.3.
点评 本题考查物质的量有关计算、一定物质的量浓度溶液配制,注意根据c=$\frac{n}{V}$理解溶液配制原理与误差分析.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 ,DA4的结构式为
,DA4的结构式为 ;
;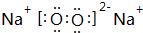 ,D元素在周期表中的位置第二周期IVA族;
,D元素在周期表中的位置第二周期IVA族;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
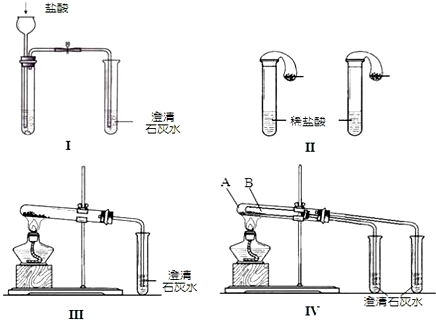
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.5g甲基(-CH3)所含有的电子数是NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 常温常压下,1molCnH2n+2中所含有的共价键数目为(3n+1)NA | |
| D. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向溶液X的稀溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 溶液X中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
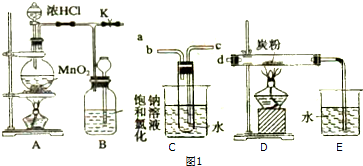
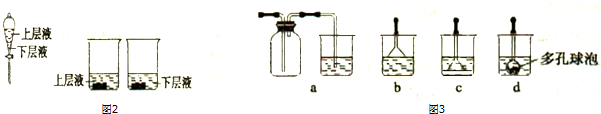
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用激光笔照射鸡蛋白水溶液 | 有丁达尔效应 | 鸡蛋白分子直径介于1nm~100nm |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 碳酸盐X加热分解,产生的气体通入酸化的BaCl2溶液 | 产生白色沉淀 | X可能是NaHCO3 |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com