
| A. | 1.5g甲基(-CH3)所含有的电子数是NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 常温常压下,1molCnH2n+2中所含有的共价键数目为(3n+1)NA | |
| D. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA |
分析 A、依据n=$\frac{m}{M}$计算物质的量结合甲基结构计算电子数;
B、乙烯和丙烯的最简式为CH2,计算14gCH2中所含碳原子数;
C、根据烷烃中含有的碳碳键和碳氢键计算出1mol中含有的共价键数目;
D、标况下,戊烷为液态.
解答 解:A、1.5 g甲基(-CH3)物质的量=$\frac{1.5g}{15g/mol}$=0.1mol,所含电子总数为0.9NA,故A错误;
B、乙烯和丙烯的最简式为CH2,计算14gCH2中所含碳原子数=$\frac{14g}{14g/mol}$×1×NA=NA,故B正确;
C、1molmolCnH2n+2(烷烃)中含有(n-1)mol碳碳键和(2n+2)mol碳氢键,总共含有(3n+1)mol共价键,含有共价键数为(3n+1)NA,故C正确;
D、标况下,戊烷为液态,不能根据气体摩尔体积来计算其物质的量,故D错误;
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
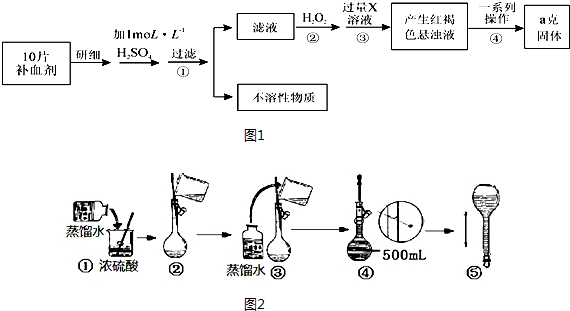
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
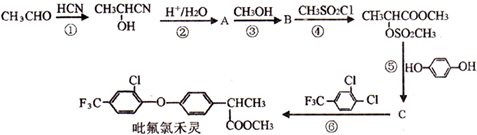
 .
. .
.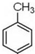 制备高分子化合物
制备高分子化合物 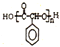 的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2$→_{170℃}^{H_{2}SO_{4}}$CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2$→_{170℃}^{H_{2}SO_{4}}$CH2$→_{催化剂△}^{H_{2}}$CH3CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. |  能量变化如图所示的反应 | |
| C. | 燃烧反应和中和反应 | |
| D. | 化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+=2Fe3++2H2O | |
| B. | MgSO4溶液滴入到Ba(OH)2溶液中:SO42-+Ba2+=BaSO4↓ | |
| C. | 向NaAlO2溶液中通入足量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | |
| D. | FeCl3溶液中加入少量NaHS溶液:Fe3++3HS-+3H2O=Fe(OH)3↓+3H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO和NO2的排放能引起酸雨,还可能引起光化学烟雾 | |
| B. | 太阳能电池与普通电池相同,都可以把化学能转化为电能 | |
| C. | 含有重金属盐的皮革废料经水解制成的粉状物可掺入奶粉中 | |
| D. | 普通玻璃可以制钢化玻璃,也可以制光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL | B. | 40mL | C. | 50mL | D. | 60mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com