
| A. | 用10mL量筒量取7.36mLNaOH 溶液 | |
| B. | 用托盘天平称取6.85g食盐 | |
| C. | 用标准的盐酸滴定未知浓度的NaOH 溶液,用去盐酸21.10mL | |
| D. | 用广泛pH 试纸测得某溶液pH 为5.5 |
分析 A.量筒的感量为0.1mL;
B.托盘天平的感量为0.1g;
C.滴定管的感量为0.01mL;
D.广泛pH 试纸测pH为正整数.
解答 解:A.量筒的感量为0.1mL,则用10mL量筒量取7.3mL或7.4mLNaOH 溶液,故A错误;
B.托盘天平的感量为0.1g,则用托盘天平称取6.8g或6.9g食盐,故B错误;
C.滴定管的感量为0.01mL,则用标准的盐酸滴定未知浓度的NaOH 溶液,用去盐酸21.10mL,故C正确;
D.广泛pH 试纸测pH为正整数,则用广泛pH 试纸测得某溶液pH 为5或6,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的实验、实验基本技能、实验操作为解答本题关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化是高效、清洁地利用煤炭的重要途径 | |
| B. | 蚕丝的主要成分是纤维素 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
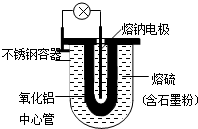 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )| A. | 熔钠电极作电池的正极 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时熔钠电极与电源的负极相连 | |
| D. | 充电时阳极反应式为8Sn2--16e-=nS8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 裂化可以提高汽油等轻质油的产量和质量 | |
| B. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| C. | 乙醇、乙酸、乙酸乙酯分子中均存在-OH | |
| D. | 向2 mL苯中加入1 mL碘的CCl4溶液,振荡后静置,上层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;GCO(NH2)2.
;GCO(NH2)2.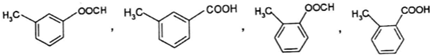 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 铵盐的质量/g | 2.15 | 4.30 | 6.45 |
| NH3的体积/mL | 672 | 1344 | 1344 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com