
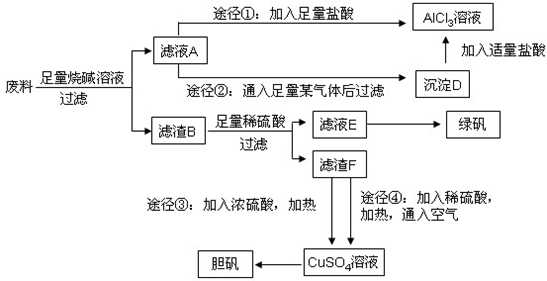
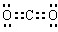 ;途径①发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O,会引入盐酸,氯化钠杂质;故答案为:
;途径①发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O,会引入盐酸,氯化钠杂质;故答案为: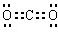 ;②;途径①制取的AlCl3溶液中混有NaCl杂质;
;②;途径①制取的AlCl3溶液中混有NaCl杂质; CuSO4+SO2↑+2H2O,途径④的反应:2Cu+O2+2H2SO4(稀)
CuSO4+SO2↑+2H2O,途径④的反应:2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O,从反应方程式看出产生等量胆矾途径④消耗硫酸少,途径④不会产生污染大气的气体,故答案为:产生等量胆矾途径④消耗硫酸少;途径④不会产生污染大气的气体;
2CuSO4+2H2O,从反应方程式看出产生等量胆矾途径④消耗硫酸少,途径④不会产生污染大气的气体,故答案为:产生等量胆矾途径④消耗硫酸少;途径④不会产生污染大气的气体;

科目:高中化学 来源: 题型:阅读理解
| +4 |
| S |
| +6 |
| S |

| 3.16nv |
| m |
| 3.16nv |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
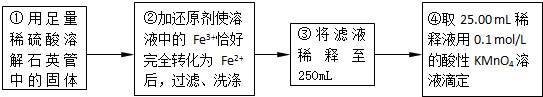
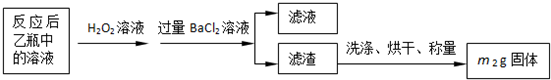
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
6![]() +10Al+18H2O
+10Al+18H2O![]() 3N2↑+10Al(OH)3+6OH-
3N2↑+10Al(OH)3+6OH-
某化学兴趣小组的同学经过探究发现还有两条途径:
(1)金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。金属镁是由海水中提取的MgCl2通过电解制得的。若要除去1 m3废水中0.3 mol的![]() ,则至少需要含0.5%(质量分数)MgCl2的海水多少千克?
,则至少需要含0.5%(质量分数)MgCl2的海水多少千克?
(2)将甲醇加入含![]() 的废水中也可消除氮的污染,它可在一种微生物作用下发生反应:
的废水中也可消除氮的污染,它可在一种微生物作用下发生反应:
6![]() +6H++5CH3OH
+6H++5CH3OH![]() 3N2↑+5CO2↑+13H2O
3N2↑+5CO2↑+13H2O
若某废水用上述方法处理时,![]()
![]() N2的转化率为a%,那么每天处理此含
N2的转化率为a%,那么每天处理此含![]() 为b g·L-1的废水V m3(密度1 g·cm-3),需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
为b g·L-1的废水V m3(密度1 g·cm-3),需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com