
【题目】高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
(1)FeO42﹣与水反应的方程式为4FeO42﹣+10H2O4Fe(OH)3+8OH﹣+3O2↑,K2FeO4在处理水的过程中所起的作用有;
(2)与MnO2﹣Zn电池类似,K2FeO4﹣Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为;
(3)将适量K2FeO4配制成c(FeO42﹣)=1.0×10﹣3molL﹣1(1.0mmolL﹣1)的试样,FeO42﹣在水溶液中的存在形态如图所示.下列说法正确的是(填字母) 
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4﹣的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH﹣=HFeO4﹣+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4﹣比例相当
(4)HFeO4﹣═H++FeO42﹣的电离平衡常数表达式为K,其数值接近(填字母).
A.10﹣2.5
B.10﹣6
C.10﹣7
D.10﹣10
(5)25℃时,CaFeO4的Ksp=4.536×10﹣9 , 若要使100mL,1.0×10﹣3molL﹣1的K2FeO4溶液中的c(FeO42﹣ )完全沉淀(一般认为离子浓度小于1×10﹣5molL﹣1时上为完全沉淀),则理论需控制溶液中Ca2+浓度至少为 .
【答案】
(1)能够消毒杀菌,同时FeO42﹣被还原成Fe3+ , Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质
(2)FeO42﹣+3eˉ+4H2O=Fe(OH)3+5OH﹣
(3)BD
(4)C
(5)4.536×10﹣5mol?L﹣1
【解析】解:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,同时FeO42﹣ 被还原成Fe3+ , Fe3+水解形成Fe(OH)3胶体,具有吸附悬浮杂质的作用;
所以答案是:能够消毒杀菌,同时FeO42﹣ 被还原成Fe3+ , Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质;
(2.)正极是FeO42﹣发生还原反应生成氢氧化铁,电极反应式为:FeO42﹣+3eˉ+4H2O=Fe(OH)3+5OH﹣ , 所以答案是:FeO42﹣+3eˉ+4H2O=Fe(OH)3+5OH﹣;
(3.)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4﹣的分布分数先增大后减小,故正确;
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4﹣+OH﹣=FeO42﹣+H2O,故错误;
D.根据图片知pH约为2.5 时,溶液中H3FeO4+和HFeO4﹣比例相当,故正确;
故选BD;
(4.)HFeO4﹣H++FeO42﹣的电离平衡常数表达式为K= ![]() ,根据图象知,等HFeO4﹣和FeO42﹣
,根据图象知,等HFeO4﹣和FeO42﹣
浓度相等时,溶液中氢离子浓度接近中性,所以K接近10﹣7 ,
所以答案是:C;
(5.)25℃时,CaFeO4的Ksp=4.536×10﹣9 , 若要使100mL1.0×10﹣3molL﹣1的K2FeO4溶液中的c(FeO42﹣ )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量= ![]() =
= ![]() =4.536×10﹣5 , 所以答案是:4.536×10﹣5molL﹣1 .
=4.536×10﹣5 , 所以答案是:4.536×10﹣5molL﹣1 .
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理)的相关知识才是答题的关键.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述正确的是( )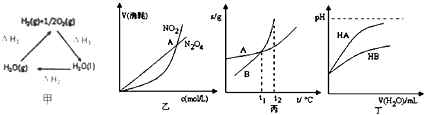
A.甲中△H1=﹣(△H2+△H3)
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A,B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.
完成下列填空:
(1)将4.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100mol/L的硫酸滴定,至终点时耗用硫酸20.00mL.甲醛水溶液的浓度为;上述滴定中,若滴定管规格为50mL,甲醛水溶液取样不能超过mL.
(2)甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:HCHO+2Cu(OH)2![]() HCOOH+Cu2O↓+2H2O,每1mol甲醛参加反应转移的电子数为个.甲醛中的碳的杂化方式为 . (填sp、sp2、sp3)
HCOOH+Cu2O↓+2H2O,每1mol甲醛参加反应转移的电子数为个.甲醛中的碳的杂化方式为 . (填sp、sp2、sp3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种酸溶液,能跟锌片反应生成氢气且最初反应速率最快的是
A. 20℃ 20mL 2mol/L的硫酸溶液B. 20℃ 30mL 2mol/L的盐酸溶液
C. 10℃ 20mL 3mol/L的盐酸溶液D. 50℃ 10mL8mol/L的硝酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把aL一个大气压,120℃的氢气氧气混合于密闭容器中,电火花引爆后恢复至原状态,测得体积为bL,则下列表述不可能正确的是( )
A.2a=3b
B.7b=4a
C.原混合气体中V(H2)=bL,V(O2)=(a﹣b)L
D.原混合气体中V(H2)=2(a﹣b)L,V(O2)=(2b﹣a)L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的锌粒投入100mL 18.5mol/L的浓硫酸中,待锌粒完全溶解后,测得生成的H2和SO2共33.6L(标准状况),此时溶液中尚余0.1mol H+ . 计算可知:
(1)投入锌粒的质量为g.
(2)生成的H2和SO2的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属钠的说法中,错误的是( )
A. 钠只有在加热条件下才能与氯气反应
B. 钠与氧气反应的产物与反应条件有关
C. 钠在反应中易失电子,表现出还原性
D. 少量的钠应保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于有机物 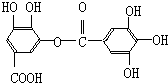 的叙述中不正确的是( )
的叙述中不正确的是( )
A.常温下,与Na2CO3溶液反应放出CO2
B.能发生水解反应,1 mol 该有机物能与8 mol 的NaOH反应
C.与稀硫酸共热能生成两种有机物
D.该物质的化学式是C14H10O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表,下列叙述中不正确的是 ( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C. 在非金属元素区域可以寻找制备新型农药材料的元素
D. 在地球上元素的分布和它们在元素周期表中的位置有密切关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com