
【题目】铜及其化合物在生产、生活中有广泛的应用。某研究性学习小组的同学对铜常见化合物的性质和制备进行实验探究,研究的问题和过程如下:
I.探究不同价态铜的稳定性
进行如下实验:
(1)向![]() 中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为:__________。由此可知,在酸性溶液中,
中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为:__________。由此可知,在酸性溶液中,![]() 价Cu比+1价Cu更_______(填“稳定”或“不稳定”)。
价Cu比+1价Cu更_______(填“稳定”或“不稳定”)。
(2)将![]() 粉末加热至
粉末加热至![]() 以上完全分解成红色的
以上完全分解成红色的![]() 粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更_______(填“稳定”或“不稳定”)。
粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更_______(填“稳定”或“不稳定”)。
II.探究通过不同途径制取硫酸铜
(1)途径A:如下图

①杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)
a.该条件下铜无法被氧气氧化 b.灼烧不充分,铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧过程中部分氧化铜被还原
②测定硫酸铜晶体的纯度:
某小组同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用![]() 标准溶液滴定至终点,共消耗
标准溶液滴定至终点,共消耗![]() 标准溶液。上述过程中反应的离子方程式如下:
标准溶液。上述过程中反应的离子方程式如下:![]() 。则样品中硫酸铜晶体的质量分数为_________________
。则样品中硫酸铜晶体的质量分数为_________________
(2)途径B:如下图

①烧瓶内可能发生反应的化学方程式为_______________ (已知烧杯中反应:![]() )
)
②下图是上图的改进装置,其中直玻璃管通入氧气的作用是_____________________。

Ⅲ.探究用粗铜(含杂质Fe)按下述流程制备氯化铜晶体![]() 。
。

(1)实验室采用如下图所示的装置,可将粗铜与![]() 反应转化为固体l(部分仪器和夹持装置已略去),
反应转化为固体l(部分仪器和夹持装置已略去),

有同学认为应在浓硫酸洗气瓶前增加吸收![]() 的装置,你认为是否必要________(填“是”或“否”)
的装置,你认为是否必要________(填“是”或“否”)
(2)将溶液2转化为![]() 的操作过程中,发现溶液颜色由蓝色变为绿色。
的操作过程中,发现溶液颜色由蓝色变为绿色。
已知:在氯化铜溶液中有如下转化关系:[Cu(H2O)4]2+(aq,蓝色)+4Cl-(aq) ![]() CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明
CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明![]() 溶液中有上述转化关系的是_____________(填序号)(已知:较高浓度的
溶液中有上述转化关系的是_____________(填序号)(已知:较高浓度的![]() 溶液呈绿色)。
溶液呈绿色)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入![]() 晶体,溶液变为绿色
晶体,溶液变为绿色
c.在Y中加入![]() 固体,溶液变为绿色
固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
Ⅳ.探究测定铜与浓硫酸反应
取![]() 铜片和12mL18mol/L浓硫酸放在圆底烧瓶中共热,一段时间后停止反应,为定量测定余酸的物质的量浓度,某同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL至锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为该学生设计的实验方案能否求得余酸的物质的量浓度____________(填“能”或“不能”),其理由是_____________。
铜片和12mL18mol/L浓硫酸放在圆底烧瓶中共热,一段时间后停止反应,为定量测定余酸的物质的量浓度,某同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL至锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为该学生设计的实验方案能否求得余酸的物质的量浓度____________(填“能”或“不能”),其理由是_____________。
【答案】![]() 稳定 稳定 bd 87.5% Cu+H2SO4+2HNO3(浓)=CuSO4+2NO2↑+2H2O 3Cu+3H2SO4+2HNO3(稀)=3CuSO4+2NO↑+4H2O 氧气氧化氮氧化合物,使氮氧化物全部被氢氧化钠溶液吸收,防止污染大气 否 abc 不能 虽然甲基橙变色的pH范围为3.1~4.4,Cu(OH)2开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,Cu2+不会消耗OH-,但甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰
稳定 稳定 bd 87.5% Cu+H2SO4+2HNO3(浓)=CuSO4+2NO2↑+2H2O 3Cu+3H2SO4+2HNO3(稀)=3CuSO4+2NO↑+4H2O 氧气氧化氮氧化合物,使氮氧化物全部被氢氧化钠溶液吸收,防止污染大气 否 abc 不能 虽然甲基橙变色的pH范围为3.1~4.4,Cu(OH)2开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,Cu2+不会消耗OH-,但甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰
【解析】
I.(1)物质都有由不稳定物质转化为稳定物质的倾向,所以在酸性溶液中,+2价Cu比+1价Cu更稳定;
(2)在高温下CuO分解产生Cu2O、O2,说明Cu2O比CuO在高温下稳定;
II.(1)①Cu未完全反应、部分氧化铜能被有机物还原;
②根据Cu元素守恒和反应方程式可得关系式,然后利用关系式计算CuSO45H2O的质量,最后根据质量分数的含义计算硫酸铜晶体的含量;
(2)①Cu与稀硫酸、浓硝酸(或随着反应进行浓硝酸变为的稀硝酸)反应产生硫酸铜、NO2(或NO)、H2O,根据氧化还原反应规律书写反应方程式;
②O2可以将NO氧化为NO2,可以将NO、NO2驱赶进入NaOH溶液中,发生反应,防止大气污染;
III.(1) HCl对反应没有影响;
(2)根据平衡移动原理分析;
IV.含铜离子溶液呈蓝色,对观察指示终点颜色有干扰。
I.(1)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,这说明氧化亚铜和稀硫酸反应生成的是硫酸铜、水和单质铜,该反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,这说明在酸性溶液中,+2价Cu比+1价Cu更稳定;
(2)将![]() 粉末加热至
粉末加热至![]() 以上完全分解成红色的
以上完全分解成红色的![]() 粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更稳定;
粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更稳定;
II.(1)①a.加热条件下铜易被氧气氧化,a错误;
b.灼烧不充分,铜未被完全氧化导致含有铜单质,b正确;
c.氧化铜在加热过程中不会分解生成铜,c错误;
d.灼烧过程中部分氧化铜被有机物还原生成铜单质,d正确;
故合理选项是bd;
②根据方程式![]() 可知:2Cu2+~I2~2S2O32-,n(S2O32-)=0.1000mol/L×0.014L×10=1.4×10-2mol,则n(Cu2+)=1.4×10-2mol,m(CuSO45H2O)= 1.4×10-2mol×250g/mol=3.5g,所以硫酸铜晶体的质量分数为(3.5g÷4.0g)×100%=87.5%;
可知:2Cu2+~I2~2S2O32-,n(S2O32-)=0.1000mol/L×0.014L×10=1.4×10-2mol,则n(Cu2+)=1.4×10-2mol,m(CuSO45H2O)= 1.4×10-2mol×250g/mol=3.5g,所以硫酸铜晶体的质量分数为(3.5g÷4.0g)×100%=87.5%;
(2)①Cu与稀硫酸、浓硝酸(或随着反应进行浓硝酸变为的稀硝酸)反应生成硫酸铜、NO2(或NO)、H2O,根据氧化还原反应规律,可得反应方程式为:![]()
![]() ;
;
②NO不能被NaOH溶液吸收,O2可以将NO氧化为NO2,使氮氧化物完全被NaOH溶液吸收,同时可以将NO、NO2驱赶进入NaOH溶液中,发生反应,转化为NaNO2、NaNO3,防止大气污染;
III.(1) Cl2中混有的HCl对反应没有影响,因此不需要在浓硫酸洗气瓶前增加吸收HCl的装置;
(2) a.将Y稀释,平衡向左移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,a正确;
b.在Y中加入CuCl2晶体,溶液中[Cu(H2O)4]2+、Cl-浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,d错误;
故合理选项是abc;
IV.甲基橙变色的pH范围是 3.1~4.4,Cu(OH)2开始沉淀的pH=5,在指示剂变色范围之外,即酸被碱中和时,Cu2+不会消耗OH-,但是甲基橙由红色变成橙色、黄色时,Cu2+溶液呈蓝色,对观察指示终点颜色有干扰,因此不能测定剩余硫酸的物质的量浓度。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如右:

回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为:__________________、_______________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是___________,滤渣是________;过滤操作②的滤液是____________和____________,滤渣是_______。
(3)工艺过程中③和④的目的是______________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是____________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为__________________;
列式计算该成品的纯度____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2、CH4、Na2O2置于密闭容器中,在250℃下用电火花引发化学反应。反应停止后使容器内恢复至250℃,容器内的气压为零。由此得出的结论正确的是( )
A. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaHCO3
B. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是Na2CO3和NaOH
C. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaOH
D. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是NaHCO3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙、丁四个装置,下列说法不正确的是
A.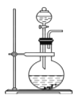 装置甲可作为制取NO2的发生装置
装置甲可作为制取NO2的发生装置
B. 装置乙可作为制取NO的收集装置
装置乙可作为制取NO的收集装置
C.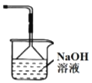 装置丙可作为制取Cl2的尾气吸收装置
装置丙可作为制取Cl2的尾气吸收装置
D. 装置丁可用于除去NH3中H2O
装置丁可用于除去NH3中H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,
时,![]() 及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )

A. 溶液的pH=5时,硫元素的主要存在形式为![]()
B. 当溶液恰好呈中性时: c(Na+)>c(HSO3-)+c(SO32-)
C. 向pH=8的上述溶液中滴加少量澄清石灰水, 的值增大
的值增大
D. 向pH=3的上述溶液中滴加少量稀硫酸,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )

A. a反应:Fe2++2H++H2O2=Fe3++2H2O
B. b反应:HCO3-+OH-=CO32-+H2O
C. c反应:H++OH-=H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 钢铁发生吸氧腐蚀时,铁做负极被氧化 Fe-2e- = Fe2+
B. Na2CO3 溶液显碱性 CO32-+2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
C. 氯气通入NaOH溶液得到漂白液 Cl2 + 2OH- = Cl- + ClO- + H2O
D. 向Mg(OH)2悬浊液中滴加FeCl3溶液,生成Fe(OH)3 :3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3↓+3Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚CH3OCH3又称甲醚,熔点-141.5℃,沸点-24.9℃。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.0 kJ·mol-1
CH3OH(g) △H1 =-90.0 kJ·mol-1
②2CH3OH(g) ![]() CH3OCH3(g)+ H2O(g) △H2 = -20.0 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2 = -20.0 kJ·mol-1
回答下列问题:
(1)反应①在_____________(填“低温”或“高温”)下易自发进行。
(2)写出由合成气(CO、H2)直接制备CH3OCH3的热化学方程式:______________。
(3)温度为500K时,在2L的密闭容器中充入2mol CO和6molH2发生反应①、②,5min时达到平衡,平衡时CO的转化率为60%,c(CH3OCH3) = 0.2 mol·L-1,用H2表示反应①的速率是________,反应②的平衡常数K =____________。
(4)研究发现,在体积相同的容器中加入物质的量相同的CO和H2发生反应①、②,在不同温度和有无催化剂组合下经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO转化(%) | CH3OCH3选择性(%) |
473 | 无 | 10 | 36 |
500 | 无 | 12 | 39 |
500 | Cu/ZnO | 20 | 81 |
(备注)二甲醚选择性:转化的CO中生成CH3OCH3百分比
①相同温度下,选用Cu/ZnO作催化剂,该催化剂能_______ (填标号)。
A.促进平衡正向移动 B.提高反应速率 C.降低反应的活化能
D.改变反应的焓变 E.提高CO的平衡转化率
②表中实验数据表明,在500K时,催化剂Cu/ZnO对CO转化成CH3OCH3的选择性有显著的影响,其原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com