
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g)===H2+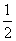 O2(g) ΔH=-485 kJ·mol-1
O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+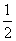 O2(g) ΔH=+485 kJ·mol-1
O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g)
ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g)
ΔH=-485 kJ·mol-1
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
X元素的阳离子和Y元素的阴离子具有相同的核外电子层结构。下列叙述中正确的是
A. 原子序数:X<Y B.原子半径:X<Y
C. 原子半径:X>Y D. 原子最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
以甲苯为主要原料合成麻黄素的合成路线如下
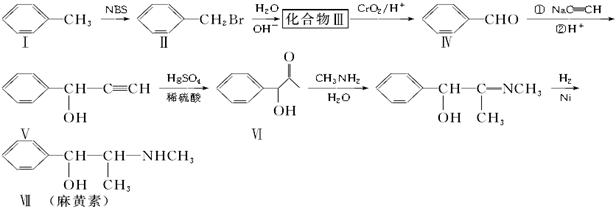
(1)化合物Ⅵ的分子式为________。
(2)化合物Ⅰ、Ⅱ、Ⅳ、Ⅴ能使Br2的CCl4溶液褪色是_______________________。
(3)化合物Ⅲ的结构简式为________,生成化合物Ⅶ的反应类型为________。
(4)在浓硫酸和加热条件下,麻黄素可以发生消去反应,该反应方程式为________________。(5)任意写出满足下列条件的化合物Ⅵ的二种同分异构体______________________。
①含一个苯环 ②无酸性,酸性条件下水解生成两种有机物 ③能发生银镜反应
(6)如何通过实验证明化合物Ⅱ分子中含有溴元素,简述实验操作:
_________________________________________________
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F、G都是中学化学常见的物质,下图中A为淡黄色固体,
B、C为溶液,D、G为无色气体,E、F为白色沉淀。
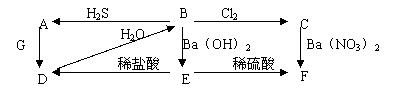
①写出B→C的离子方程式
②写出D和G反应的化学方程式
③写出过量的D通入Ba(OH)2溶液中的离子方程式
④从上图出现的物质中选出反应物,写出一个置换反应,以验证氯元素原子的氧化性比
硫元素原子的氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为
H2O2+I-―→H2O+IO- 慢
H2O2+IO-―→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
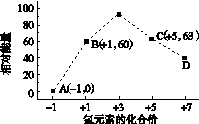
(4)一定条件下,在水溶液中1 mol Cl-、ClO (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
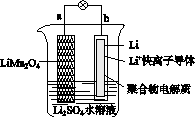
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S

①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
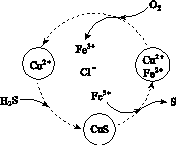
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是
。燃烧生成的SO2与H2S进一步反应,生成 物在常温下均非气体,写出该反应的化学方程式: 。
物在常温下均非气体,写出该反应的化学方程式: 。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是 。

(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com