
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S

①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
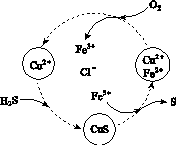
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。

(1)①2H2O+2e-===H2↑+2OH- ②S +2H+===(n-1)S↓+H2S↑
+2H+===(n-1)S↓+H2S↑
(2)①Cu、H、Cl(或铜、氢、氯) ②0.5 mol ③提高混合气体中空气的比例
(3)2H2S 2H2+S2
2H2+S2
[解析] (1)①电解池的阴极发生还原反应,溶液中H2O电离出的H+被还原为H2,即2H2O+2e-===H2↑+2OH-;②在酸性条件下,S2-与H+结合生成H2S,故S 与酸发生反应:S
与酸发生反应:S +2H+===(n-1)S↓+H2S↑。(2)①由图示可知,最终产物为CuS、HCl、S和FeCl3,因而Cu、H、Cl三种元素的化合价未变。②根据电子守恒,1 mol H2S转化为S,失去2 mol电子,而1 mol O2消耗4 mol电子,故1 mol H2S消耗0.5 mol O2。③为了把CuS转化为S,应加入氧化剂,在溶液的量不增加的前提下,只能增加O2的量,即增加空气的量。(3)结合图像可知,体系中有3种组分,说明H2S未完全分解,即属于可逆反应。选取某温度下各组分的体积分数,如选取1300 ℃下各组分的体积分数,结合S原子守恒,推出硫蒸气的组成为S2,可得反应为2H2S
+2H+===(n-1)S↓+H2S↑。(2)①由图示可知,最终产物为CuS、HCl、S和FeCl3,因而Cu、H、Cl三种元素的化合价未变。②根据电子守恒,1 mol H2S转化为S,失去2 mol电子,而1 mol O2消耗4 mol电子,故1 mol H2S消耗0.5 mol O2。③为了把CuS转化为S,应加入氧化剂,在溶液的量不增加的前提下,只能增加O2的量,即增加空气的量。(3)结合图像可知,体系中有3种组分,说明H2S未完全分解,即属于可逆反应。选取某温度下各组分的体积分数,如选取1300 ℃下各组分的体积分数,结合S原子守恒,推出硫蒸气的组成为S2,可得反应为2H2S 2H2+S2。
2H2+S2。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
⑴ C元素在元素周期表中的位置是____________。
⑵ C和E两种元素相比较,非金属性较强的是(填元素名称)____________,可以验证该结论的是(填写编号)______________。
A.比较这两种元素的常见单质的沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
⑶ A、C、E间可形成甲、乙两种微粒,它们均为-1价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
_______________________________。
⑷ F含有的化学键类型是______________,请用相关的离子方程式表示其与KOH稀溶液之间的反应____________________________________。
⑸ D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g)===H2+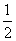 O2(g) ΔH=-485 kJ·mol-1
O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+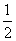 O2(g) ΔH=+485 kJ·mol-1
O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g)
ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g)
ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.光催化还原水制氢比电解水制氢更节能环保、更经济
B.氨氮废水(含NH 及NH3)可用化学氧化法或电化学氧化法处理
及NH3)可用化学氧化法或电化学氧化法处理
C.某种化学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12 L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
D.向汽油中添加甲醇后,该混合燃料的热值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是________。
(2)Ⅰ中,Fe3+产生的原因还可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的离子方程式:________________________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电。原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法:_____________________________________________________________________。
③与Ⅱ对比,得出的结论(写出两点):______________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的反应条件是________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),则反应Ⅱ的Kp=________(用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1 )大于反应Ⅱ的速率(v2 ),则下列反应过程能量变化示意图正确的是________。
(4)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是____________________________________________________________________。
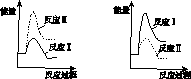
A B
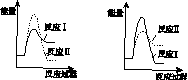
C D
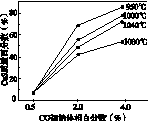
(5)图(a)为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有________。
A.向该反应体系中投入石灰石
B.在合适的温度区间控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图(b)画出反应体系中c(SO2)随时间t变化的总趋势图。
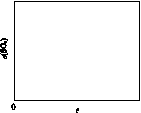
(a) (b)
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl+O2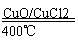
 2Cl2+2H2O
2Cl2+2H2O
(1)已知:Ⅰ反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
Ⅱ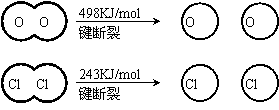

H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________KJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“若”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1、]下,反应温度对HCl平衡转化率影响的曲线。
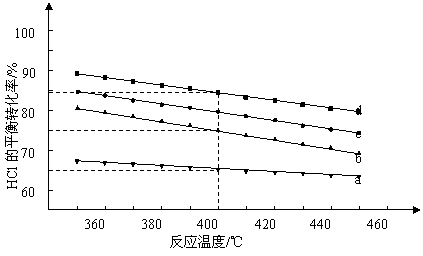

①曲线b对应的投料比是______________.
②当曲线b, c, d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投
料比的关系是_________________.
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A.43.2g B. 46.8g C. 53.6g D. 63.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com