
某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
科目:高中化学 来源:2014-2015湖南省长沙市望城区高二上学期期末化学理科试卷(解析版) 题型:填空题
(10分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液c;M、N是两块电极板,通过导线与直流电源相连。

请回答以下问题:
(1)若M、N都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则: 极(填“M”或“N”)附近先呈红色;电解饱和NaCl溶液的总反应方程式: 。
(2)若要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①N电极反应式是 。(说明:杂质发生的电极反应不必写出)
②下列说法正确的是________。
A.电能全部转化为化学能
B.在电解精炼中,电解液中有Al3+、Zn2+产生
C.溶液中Cu2+向阳极移动
D.阳极泥中可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为16g,则阳极上产生的气体在标准状况下的体积为 L 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省师大一附高一上学期期中化学试卷(解析版) 题型:选择题
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是
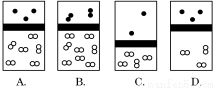
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高一上学期期中化学试卷(解析版) 题型:填空题
(8分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- ,
(2)由第二份进行的实验可知混合物中应含 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是( )
A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol
B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl-
C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl-
D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高一上学期期中化学试卷(解析版) 题型:选择题
关于O2与O3气体,下列比值一定为2:3的是
A.若两种气体所占体积相同,两种气体的质量之比
B.若温度和压强相同,两种气体的密度之比
C.若两种两种气体原子数相同,两种气体的质子数之比
D.若两种气体的质量相同,两种气体的分子数之比
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高一上学期期中化学试卷(解析版) 题型:选择题
下列关于物质的量浓度表述正确的是
A.0.3 mol?L﹣1的Na2SO4溶液中含有Na+和SO42﹣的总物质的量为0.9 mol?L﹣1
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol?L﹣1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol?L﹣1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42﹣的物质的量相等,则K+和Cl﹣的物质的量浓度一定相同
D.10℃时,100 mL 0.35 mol?L﹣1的KCl饱和溶液蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol?L﹣1
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高一上学期期中化学试卷(解析版) 题型:选择题
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫“铝铍测年法”。下列有关26Al和10Be的说法正确的是
A.10Be和9Be是中子数不同质子数相同的同种核素
B.10Be的原子核内质子数等于中子数
C.5.2 g 26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数和核外电子数均不同,中子数相同
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期期末考试化学试卷(解析版) 题型:选择题
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+ D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期12月联考化学试卷(解析版) 题型:填空题
(12分)(Ⅰ)硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
①BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+ 571.2 kJ?mol—1
②BaS(s)=Ba(s)+S(s) △H=+460 kJ?mol—1
已知:③2C(s)+O2(g)=2CO(g) △H= -221 kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(Ⅱ)污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施就洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图

则:
①△H3 0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应离子方程式为: 。
②电化学降解NO3-的原理如图,阴极反应式为: 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com