
【题目】常温下,向20.00mL0.1mol/L的甲胺(CH3NH2)溶液中滴加0.1mol/L 的盐酸,混合溶液的pH与相关微粒浓度比值的对数关系如图所示。下列说法不正确的是( )
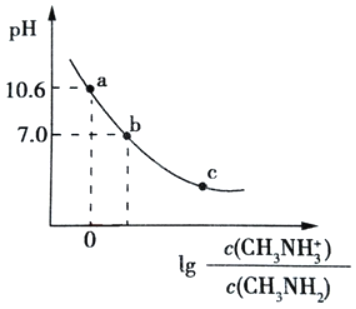
A.已知甲胺的碱性稍强于氨,甲胺在水中的电离方程式为CH3NH3++H2OCH3NH2+OH﹣
B.b点加入的盐酸体积V<20.00 mL
C.将等物质的量的CH3NH2和CH3NH3Cl 溶于蒸馏水,可得到 a 点对应的溶液
D.常温下,甲胺的电离常数为 Kb,则 pKb=-lgKb=3.4
【答案】C
【解析】
A.甲胺(CH3NH2)类似于氨,但碱性稍强于氨,说明甲胺也是弱电解质,在水溶液中部分电离,其电离方程式为CH3NH2+H2OCH3NH3++OH﹣,故A正确;
B.CH3NH3Cl为强酸弱碱盐,其水溶液呈酸性,要使混合溶液呈中性,则甲胺应该稍微过量,甲胺和稀盐酸浓度相等,所以甲胺体积大于盐酸,则加入稀盐酸体积小于20mL,故B正确;
C.将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,CH3NH2电离程度大于CH3NH3Cl水解程度,所以溶液中c(CH3NH3+)>c(CH3NH2),lg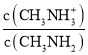 >0,应该在a、b之间,故C错误;
>0,应该在a、b之间,故C错误;
D.当lg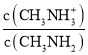 =0时,c(CH3NH2)=c(CH3NH3+),溶液的pH=10.6,则Kb=
=0时,c(CH3NH2)=c(CH3NH3+),溶液的pH=10.6,则Kb=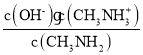 =c(OH﹣)=
=c(OH﹣)=![]() =10﹣3.4,所以pKb=﹣lgKb=3.4,故D正确;
=10﹣3.4,所以pKb=﹣lgKb=3.4,故D正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示是425℃时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。
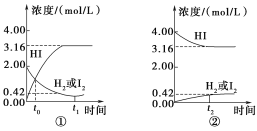
下列叙述错误的是( )
A. 图①中t0时,三种物质的物质的量相同
B. 图①中t0时,反应达到平衡状态
C. 图②中的可逆反应为2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
D. 图①②中当c(HI)=3.16 mol/L时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
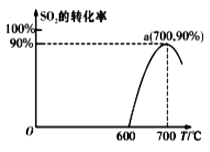
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.
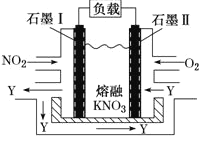
石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在钨酸盐催化作用下,以马来酸酐为原料,双氧水为氧化剂可合成环氧琥珀酸。马来酸酐转化率和环氧琥珀酸选择性随温度和催化剂用量的变化如图所示(保持其他条件相同)。下列说法不正确的是( )
![]()
![]()
![]()
![]()
![]()
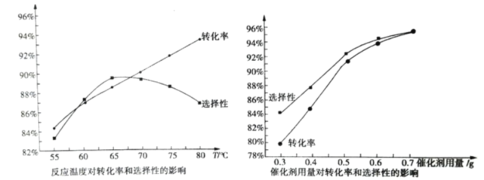
A.环氧琥珀酸的选择性随催化剂用量的增加而增加,故催化剂用量越多越好
B.当温度低于 65℃时,环氧琥珀酸的选择性随温度升高而增大
C.升高到一定温度后环氧琥珀酸的选择性降低,原因可能是环氧琥珀酸发生了水解反应
D.本实验适宜的反应温度为 65℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下:
![]()
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述反应中只有③属于氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:

(1)写出通入CO2和NH3的化学反应方程式_________________________________________________。在 饱和食盐水中通入CO2和NH3,先通NH3后通CO2的原因是_____________________________。
(2)母液中除H+和OH-外,还含有的离子是_____________。 向母液中通氨气,加入细小食盐颗粒,冷却 析出副产品,通氨气的作用有____________。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(3)上述流程中X物质的分子式_______。使原料氯化钠的利用率从70%提高到90%以上,主要是 设计了_______(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____。
(4)写出检验产品碳酸钠中是否含有氯化钠的简要方案:___________________________________________________________________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
称取样品ag,加水溶解,加入足量的BaCl2溶液,经过滤、洗涤、干燥,最终得到固体bg。样品中纯 碱的质量分数为___________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaC1O2的实验流程如图所示,反应I的化学方程式为: 3NaC1O3+4SO2+3H2O=2C1O2+Na2SO4+3H2SO4+NaCl,下列说法正确的是
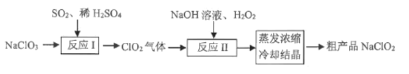
A.NaClO2的漂白原理与SO2相同
B.反应I中氧化产物和还原产物物质的量比为4:3
C.反应II中H2O2做氧化剂
D.实验室进行蒸发操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是

A. 该装置中Cu极为正极
B. 当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C. b极反应的电极反应式为:H2-2e-=2H+
D. 一段时间后锌片质量减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com