
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
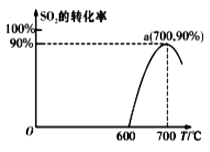
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.
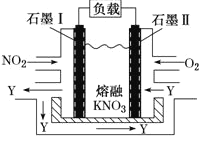
石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
【答案】+95.5 kJ·mol-1 ΔS>0 0.15 36.45 < AD NO2+NO3--e-=N2O5 0.5
【解析】
(1)根据盖斯定律(反应1+反应2)×(-1)得到;反应自发进行的条件是△H-T△S<0;
(2)①利用反应的三段式结合反应速率公式、平衡常数表达式计算;
②700℃时升高温度,SO2的转化率降低,则平衡逆向移动,正向反应为放热反应,该体系相当在恒温恒容平衡体系中升温,平衡逆向移动;
③化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(3)石墨I为电池的负极:NO2失电子生成N2O5,写出电极反应式;写出反应的总方程式再计算电子转移数。
(1)反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
根据盖斯定律(反应1+反应2)×(-1)得到:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=[-117.2 kJ·mol-1+(+21.7 kJ·mol-1)]×(-1)=+95.5 kJ·mol-1 ,该反应能自发进行的主要原因是:该反应是吸热反应,反应能发生则△S>0;
2NH3(l)+CO2(g) ΔH3=[-117.2 kJ·mol-1+(+21.7 kJ·mol-1)]×(-1)=+95.5 kJ·mol-1 ,该反应能自发进行的主要原因是:该反应是吸热反应,反应能发生则△S>0;
(2)① 反应的三段式为 2C(s)+2SO2(g)![]() S2(g)+2CO2(g)
S2(g)+2CO2(g)
起始浓度(mol·L-1) 1 0 0
变化浓度(mol·L-1) 0.9 0.45 0.9
平衡浓度(mol·L-1) 0.1 0.45 0.9
v(S2)=△c÷△t=0.45mol·L-1÷3min=0.15mol/(L·min)
该温度下的平衡常数k=![]() =
=![]() =36.45;
=36.45;
②1 mol·L-1SO2与足量的焦炭在恒容、700℃反应时,SO2的转化率为90%,若1 mol·L-1SO2与足量的焦炭在恒容、绝热容器中反应,由于反应放热,容器内温度升高,所以恒容、绝热容器中的反应相当在恒容、700℃反应平衡的基础上升温,则平衡逆向进行,SO2的转化率降低;
③A.焦炭的质量减少,则反应正向进行,焦炭的质量增加,则反应逆向进行,若焦炭的质量不再变化时,则反应达到平衡状态,故A正确;
B.CO2、SO2的浓度相等时,不能确定正逆反应速率是否相等,所以不能确定反应是否达到平衡状态,故B错误;
C.无论反应是否达到平衡,SO2的消耗速率与CO2的生成速率始终相等,所以SO2的消耗速率与CO2的生成速率之比为1:1时,不能确定反应状态是否平衡,故C错误;
D.反应正向是气体体积增大的反应,反应正向进行,容器压强增大,逆向进行,容器压强减小,所以容器的总压强不再变化时,反应达到平衡状态,故D正确;
故选AD;
(3)石墨I,NO2失电子生成N2O5,附近发生的反应为NO2+NO3--e-=N2O5;
总反应为:4NO2+O2=2N2O5,每转移4mol电子,生成2molN2O5,当外电路通过1mole-,正极上共消耗 0.5mol N2O5 。


科目:高中化学 来源: 题型:
【题目】某些资料表明:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出如下假设:
假设Ⅰ. Na2O2氧化NO2; 假设Ⅱ. NO2氧化Na2O2。
请回答下列问题:
(1)甲同学设计如图1所示实验装置:
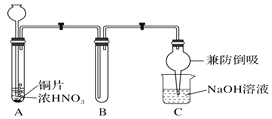
图1
①试管A中反应的离子方程式是___________________________________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。甲同学据此认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个装置,该装置的作用是__________________________________________________________________。
③乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是_____________________。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化,查阅资料知:
ⅰ) 2NO+Na2O2===2NaNO2;
ⅱ) 6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O;
ⅲ)酸性条件下,NO或NO![]() 都能与MnO
都能与MnO![]() 反应生成NO
反应生成NO![]() 和Mn2+。
和Mn2+。
丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应:
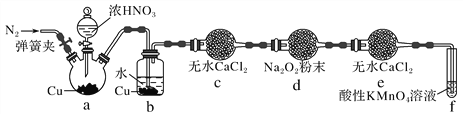
图2
①b装置中观察到的主要现象是__________________________________________________,f装置的作用是_________________________________________________________________。
②在反应前,先打开弹簧夹,通入一段时间N2,其目的是____________________________
③充分反应后,检验d装置中发生反应的实验是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;
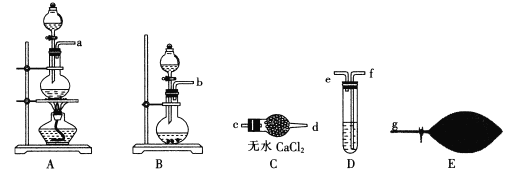
(1)为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
①用装置A制取NO,分液漏斗中盛放的是___(填试剂名称)。
②用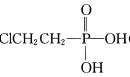 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
③用H2 C2 O4与浓硫酸制取CO(化学方程式为H2C2O4 ![]() CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
(2)乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2 H4及空气),按如图所示 装置进行尾气转化并检验。
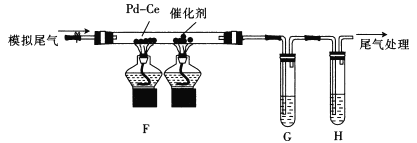
①为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_________(填标号)。
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是___;写出其中CO与NO完全转化为无害气体的化学方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为6A+2 D![]() 3B+4C
3B+4C
B. 反应进行到1 s时,v(A)=v(B)
C. 反应进行到5 s时,B的平均反应速率为0.06mol/(L·s)
D. 反应进行到5 s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、1.01×105Pa时,将3L炔烃和烷烃的混合气体与相同状况下的14LO2混合,充分燃烧后,恢复到原来状态时,所得气体的体积是17L。则该混合气体可能是下列各组中的( )
A.C2H4和C2H6B.C3H4和CH4C.C2H2和CH4D.C4H6和C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
①氧化剂与还原剂的物质的量比是_______;如果反应生成0.3mol的单质碘,则转移的电子数目是_______。
②先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是_____;
③若采用下图实验装置将四氯化碳和I2的混合溶液分离。
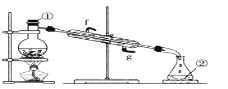
写出图中仪器的名称:①_____;该装置还缺少的仪器是_____;冷凝管的进水口是:_____(填g或f)。
(2)实验室常用MnO2和浓盐酸制氯气,反应原理:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①实验室用MnO2和浓盐酸制氯气的离子方程式:__________________________
②上述反应中氧化剂:__________,还原剂:__________,被氧化的HCl和未被氧化的HCl的比值______________。
③a : Cl2+2I-=I2+2Cl-; b: Cl2+2Fe2+=2Fe3++Cl-; c:2Fe3++2I-=I2+2Fe2+。 Cl2、I2、Fe3+的氧化性由强到弱的顺序:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol/L的甲胺(CH3NH2)溶液中滴加0.1mol/L 的盐酸,混合溶液的pH与相关微粒浓度比值的对数关系如图所示。下列说法不正确的是( )
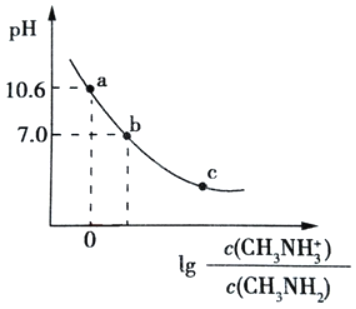
A.已知甲胺的碱性稍强于氨,甲胺在水中的电离方程式为CH3NH3++H2OCH3NH2+OH﹣
B.b点加入的盐酸体积V<20.00 mL
C.将等物质的量的CH3NH2和CH3NH3Cl 溶于蒸馏水,可得到 a 点对应的溶液
D.常温下,甲胺的电离常数为 Kb,则 pKb=-lgKb=3.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸银是一种无色晶体,常用于照相、制镜、印刷、医药等。其水溶液和固体常被保存在棕色试剂瓶中。硝酸银不稳定,受热分解生成固体、NO2 和 O2 。为了验证 AgNO3 受热分解的产物,某同学设计了以下实验,实验所用的装置如图(图中加热、夹持仪器等均略去):
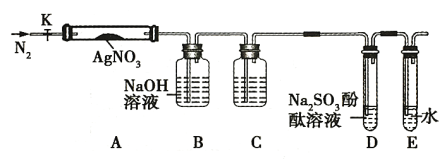
实验步骤:
a.仪器连接后,放入AgNO3固体之前,关闭K,微热硬质玻璃管A;
b.称取 AgNO3 固体1.7g 置于A中,先通一段时间N2,再关闭K,用酒精灯加热硬质玻璃管A;
c.待样品完全分解,装置A冷却至室温,称量,测得剩余固体的质量为1.08 g。
请回答下列问题:
(1)使用酒精灯对AgNO3固体加热的操作方法是_________________。
(2)步骤a的操作目的是__________________。
(3)步骤b中先通一段时间的N2的目的是_____________________。
(4)装置C瓶中盛装的药品名称为_____________(合理即可),装置D中可观察到的实验现象为__________________。
(5)根据实验现象和称量结果,请写出该装置中AgNO3固体受热分解的化学方程式__________________。
(6)从实验安全角度考虑该装置存在缺陷,应如何改进?__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com