
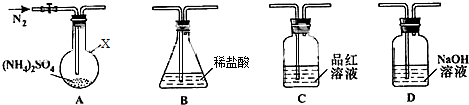
分析 (1)①仪器X为圆底烧瓶;排尽装置中生成的气体,以便被充分吸收;品红溶液不褪色和滴定后B的溶液中无SO42-,说明该条件下硫铵的分解产物除了NH3外还有生成硫酸;
②滴定前,要排尽滴定管尖嘴的气泡的操作方法为:大拇指和食指的指尖挤压玻璃球,并将尖嘴部分向上翘起;
根据消耗氢氧化钠计算B装置中剩余的HCl,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=NH4Cl,进而计算吸收NH3的物质的量,
(2)①硝酸具有强氧化性,可以将亚硫酸根氧化为硫酸根,无论是否含有亚硫酸根,再加入硝酸钡溶液得到得到白色沉淀;
②装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2.
解答 解:(1)①由仪器的结构特征可知,仪器X为圆底烧瓶;通入氮气的目的是:将A中产生的气体全部排出,被后面装置中的试剂吸收;品红溶液不褪色和滴定后B的溶液中无SO42-,说明该条件下硫铵的分解产物除了NH3外还有生成硫酸,
故答案为:圆底烧瓶;将A中产生的气体全部排出,被后面装置中的试剂吸收;H2SO4;
②滴定前,要排尽滴定管尖嘴的气泡的操作方法为:大拇指和食指的指尖挤压玻璃球,并将尖嘴部分向上翘起;
滴定剩余盐酸,终点时消耗NaOH为0.025L×0.2mol/L=0.005mol,故剩余HCl为0.005mol,则参加反应的HCl为0.07L×0.5mol/L-0.005mol=0.03mol,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=NH4Cl,故吸收NH3的物质的量为0.03mol,
故答案为:大拇指和食指的指尖挤压玻璃球,并将尖嘴部分向上翘起;0.03;
(2)①硝酸具有强氧化性,可以将亚硫酸根氧化为硫酸根,无论是否含有亚硫酸根,再加入硝酸钡溶液得到得到白色沉淀,故实验方案不合理,
故答案为:不合理,因为无论溶液中存在SO32- 还是SO42- 均会产生同样的现象;
②装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,分解反应方程式为:3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑,单位物质的量的硫铵完全分解生成二氧化硫为1mol,则转移电子的物质的量为1mol×(6-4)=2mol,
故答案为:3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑;2mol.
点评 本题考查化学实验,涉及化学仪器、滴定操作、实验方案设计、化学计算、物质推断、化学方程式书写等,是对学生综合能力的考查,较好的考查学生分析推理能力、知识迁移运用能力难度中等.


科目:高中化学 来源: 题型:解答题
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
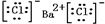 ,⑤的电子式是
,⑤的电子式是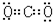 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com