
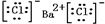 ,⑤的电子式是
,⑤的电子式是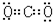 .
. 分析 先判断晶体类型,再判断化学键类型;
①BaCl2属离子晶体,只含离子键;
②金刚石属原子晶体,只含共价键;
③NH4Cl属离子晶体,含离子键、共价键、配位键;
④Na2SO4属离子晶体,含离子键、共价键;
⑤干冰属分子晶体,只含共价键;
⑥碘片属分子晶体,只含共价键;
(1)根据以上分析结合题意选择选项;
(2)根据以上分析结合题意选择选项;
(3)根据电子式的书写规则书写.
解答 解:①BaCl2属离子晶体,只含离子键;
②金刚石属原子晶体,只含共价键;
③NH4Cl属离子晶体,含离子键、共价键、配位键;
④Na2SO4属离子晶体,含离子键、共价键;
⑤干冰属分子晶体,只含共价键;
⑥碘片属分子晶体,只含共价键;
(1)含有共价键的物质是②③④⑤⑥,故答案为:②③④⑤⑥;
(2)根据以上分析,知属于离子化合物的是①③④;只有离子键的物质是①,故答案为:①③④; ①;
(3)氯化钡是离子化合物,书写电子式时要符合离子化合物的特点,干冰的成分是二氧化碳,是共价化合物,书写电子式时要符合共价化合物的特点,故答案为: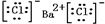 、
、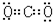 .
.
点评 本题考查的知识点较多,侧重考查学生对离子键、共价键,离子化合物、共价化合物及其电子式的书写的辨别能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大,主要原因是增加了反应物分子浓度 | |
| D. | 使用正催化剂能增大活化分子百分数,从而显著地增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+:1s22s22p63s23p6 | B. | O:1s22s22p6 | ||
| C. | P:1s22s22p63s23p3 | D. | Br:1s22s22p63s23p63d104s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
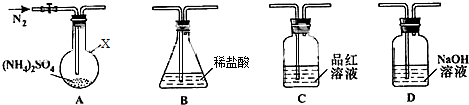
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
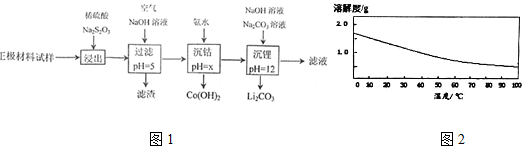
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量与阿伏加德罗常数(NA)个磷酸分子的质量在数值上相等 | |
| B. | 常温常压下,0.5NA个CO分子所占体积是11.2L | |
| C. | 1molNH4+中含有的电子数为10NA | |
| D. | 1L0.3mol/L的Na2SO4溶液中,含有Na+和 SO42-总数为0.9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com