
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
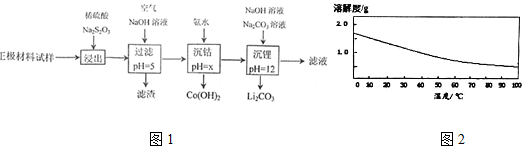
分析 废旧锂离子电池的正极材料主要含有LiCoO2(也表示为:Li2O•Co203)及少量Al、Fe等,向样品中加入稀硫酸、硫代硫酸钠,Na2S2O3被氧化为Na2SO4,Co3+被还原为Co2+,Al、Fe也溶解,然后向溶液中通入空气,Fe2+被氧化生成Fe3+,加入氢氧化钠溶液调节溶液pH=5,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,过滤除去,滤液中再加入氨水使Co2+转化为Co(OH)2沉淀,过滤后向滤液中加入Na2CO3,得到沉淀Li2CO3.
(1)搅拌、升高温度、增大酸的浓度、将正极材料粉碎等都可以加快浸出速率;
(2)浸出过程中Na2S2O3被氧化为Na2SO4,+3价Co还原为+2Co,反应生成CoSO4、Li2SO4、Na2SO4与水;用盐酸代替H2SO4和Na2S2O3,会氧化生成氯气,污染环境;
(3)滤渣的成分为氢氧化铁、氢氧化铝;溶液中通入空气将Fe2+被氧化为Fe3+,以便调节pH转化为沉淀,过滤除去;
(4)Co(OH)2是两性氢氧化物,NaOH溶液可以溶解Co(OH)2;
根据Ksp[Co(OH)2]=c(Co2+)×c2(OH-)=1.0×10-15计算c(OH-),进而计算控制溶液pH;
Co(OH)2会被空气中的O2氧化成Co(OH)3,与氢氧化亚铁氧化类似;
(5)碳酸锂的溶解度随温度的升高而减小,应采取热水洗涤,减少因溶解导致的损失.
解答 解:废旧锂离子电池的正极材料主要含有LiCoO2(也表示为:Li2O•Co203)及少量Al、Fe等,向样品中加入稀硫酸、硫代硫酸钠,Na2S2O3被氧化为Na2SO4,Co3+被还原为Co2+,Al、Fe也溶解,然后向溶液中通入空气,Fe2+被氧化生成Fe3+,加入氢氧化钠溶液调节溶液pH=5,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,过滤除去,滤液中再加入氨水使Co2+转化为Co(OH)2沉淀,过滤后向滤液中加入Na2CO3,得到沉淀Li2CO3.
(1)浸出过程中为加快浸出速率,可以采取的措施有:充分搅拌、升高温度、增大酸的浓度、将正极材料粉碎等,
故答案为:充分搅拌、升高温度等;
(2)浸出过程中Na2S2O3被氧化为Na2SO4,+3价Co还原为+2Co,反应生成CoSO4、Li2SO4、Na2SO4与水,反应方程式为:8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O,用盐酸代替H2SO4和Na2S2O3,会氧化生成氯气,污染环境,
故答案为:8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O;生成氯气,污染环境;
(3)滤渣的成分为Al(OH)3、Fe(OH)3;溶液中通入空气将Fe2+被氧化为Fe3+,以便调节pH转化为沉淀,过滤除去,
故答案为:Al(OH)3、Fe(OH)3;将Fe2+被氧化为Fe3+;
(4)Co(OH)2是两性氢氧化物,NaOH溶液可以溶解Co(OH)2,导致固体质量减少,
当溶液中c(Co2+)≤10-5mol•L-1时即认为沉淀完全,根据Ksp[Co(OH)2]=c(Co2+)×c2(OH-)=1.0×10-15,可知c(OH-)=10-5mol•L-1,故c(H+)=10-9mol•L-1,则控制溶液pH≥9,
Co(OH)2会被空气中的O2氧化成Co(OH)3,与氢氧化亚铁氧化类似,反应方程式为:4Co(OH)2+O2+2H2O=4Co(OH)3,
故答案为:Co(OH)2是两性氢氧化物,能与NaOH溶液反应导致沉淀的质量减少;9;4Co(OH)2+O2+2H2O=4Co(OH)3;
(5)碳酸锂的溶解度随温度的升高而减小,应采取热水洗涤,减少因溶解导致的损失,
故答案为:热水.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、条件控制、对原理的分析等,明确流程图中各个步骤发生的反应或操作目的是解本题关键,是对学生综合能力的考查,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2NO(g)+O2(g)═2NO2(g) | B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g) | ||
| C. | NH4NO3(s)═NH4+(aq)+NO3-(aq) | D. | H2(g)+Cl2(g)═2HCl(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯.BPA的结构简式如图所示.
双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯.BPA的结构简式如图所示.
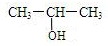 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2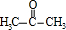 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,⑤的电子式是
,⑤的电子式是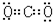 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 g]
g]查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有较多钙、镁离子的水叫做硬水 | |
| B. | 软水中不含有钙、镁离子 | |
| C. | 可以采取加热煮沸法和离子交接法软化硬水 | |
| D. | 硬水会降低肥皂的洗涤效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com