
 g]
g]分析 方案一:(1)样品称量可以得到样品质量为m1g,加入稀盐酸溶解后,过滤得到溶液为氯化钠溶液,蒸发浓缩结、冷却结晶、洗涤、干燥得到氯化钠,称量得到固体氯化钠的质量为m2g;
(2)溶解、蒸发结晶需要用到玻璃棒;
(3)操作③是从溶液中获得晶体;
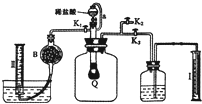
(4)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积;为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等;
(5)用碱石灰吸收二氧化碳,量筒Ⅱ中排出液态的体积为氧气体积,气流速度太快,不利于二氧化碳吸收;
(6)根据生成氧气的体积计算过碳酸钠反应生成二氧化碳的体积,结合二氧化碳的总体积可以计算碳酸钠反应生成二氧化碳的体积,根据二氧化碳的可以起到过碳酸钠与碳酸钠的物质的量之比,进而计算过碳酸钠的质量分数.
解答 解:样品称量可以得到样品质量为m1g,加入稀盐酸溶解后,过滤得到溶液为氯化钠溶液,蒸发浓缩结、冷却结晶、洗涤、干燥得到氯化钠,称量得到固体氯化钠的质量为m2g.
(1)操作①为称量固体质量,操作③为结晶得到氯化钠固体,
故答案为:称量;蒸发结晶;
(2)固体溶解需要玻璃棒搅拌加速溶解,溶液中得到溶质固体需要在蒸发皿中加热蒸发结晶,过程中需要玻璃棒搅拌,受热均匀,上述操作中,使用到玻璃棒的有②③,
故答案为:②③;
(3)溶液中得到溶质固体的方法是加热蒸发结晶析出,具体操作为:得到的溶液在蒸发皿中加热蒸发,用玻璃棒不断搅拌到大量晶体析出,停止加热靠余热蒸发剩余的水分得到氯化钠固体,
故答案为:得到的溶液在蒸发皿中加热蒸发,用玻璃棒不断搅拌到大量晶体析出,停止加热靠余热蒸发剩余的水分得到氯化钠固体;
(4)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3,为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等,所以导管a的作用是平衡分液漏斗上下的压强使顺利流下,
故答案为:K1、K2;K3; 平衡分液漏斗上下的压强使顺利流下;
(5)用碱石灰吸收二氧化碳,量筒Ⅱ中排出液态的体积为氧气体积,缓缓打开K1,让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到纯净的氧气,
故答案为:碱石灰;让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到纯净的氧气;
(6)量筒I中有xmL水,则CO2、O2的总体积为xmL,量筒Ⅱ中收集到了ymL气体,则O2总体积为y mL,则反应2Na2CO4+4HCl═4NaCl+2CO2+O2+2H2O,生成的二氧化碳为2y mL,碳酸钠反应生成二氧化碳为(x-y-2y)=(x-3y) mL,生成二氧化碳物质的量之比为2y:(x-3y),则Na2CO4与碳酸钠的物质的量之比为2y:(x-3y),故样品中过碳酸钠的质量分数是$\frac{2y×122}{2y×122+(x-3y)×106}$=$\frac{122y}{53x-37y}$,
故答案为:$\frac{122y}{53x-37y}$.
点评 本题考查了物质含量的实验测定方法,关键是理解测定原理,定量实验中尽可能减小误差,(6)中计算为易错点,注意测量气体的体积不一定是标况下,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6Cl2的同分异构体有四种 | |
| B. | 分子式为C8H10的芳香烃有3个,分别为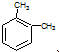 、 、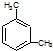 和 和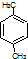 | |
| C. | 分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 | |
| D. | 二氯甲烷有两种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+:1s22s22p63s23p6 | B. | O:1s22s22p6 | ||
| C. | P:1s22s22p63s23p3 | D. | Br:1s22s22p63s23p63d104s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
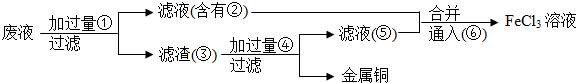
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
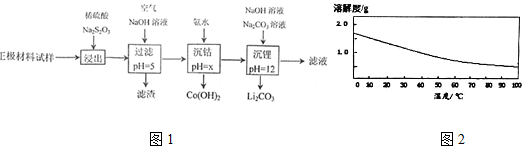
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| C. | 锌摄入量过多,也会引起缺铁性贫血 | |
| D. | 为了防止龋齿,人人都适合使用含氟牙膏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 密度/g.cm-3 | 硬度 | 导电性 | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
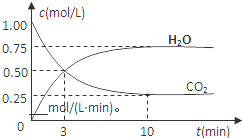
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com