
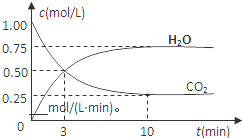
分析 (1)在25℃、101kPa下,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热22.68KJ×32=725.76KJ,依据热化学方程式的书写方法和注意问题,标注对应反应的焓变写出;
(2)①根据v=$\frac{△c}{△t}$计算;
②根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
③根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
④依据①计算得到反应消耗0.75mol/×2L=1.5mol,依据热化学方程式计算反应放出的热量;
⑤CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ/mol,反应是气体体积较小的放热反应,依据化学平衡移动原理分析判断;
解答 解:(1)在25℃、101kPa下,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热22.68KJ×32=725.76KJ,反应的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76KJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76KJ/mol;
(2)①利用三段式解题法计算,图象分析可知二氧化碳浓度为1mol/L,氢气浓度为3mol/L,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(CO2)=$\frac{0.75mol/L}{10min}$=0.075 mol•L-1•min-1,
故答案为:0.075;
②氢气的转化率=$\frac{2.25mol/L}{3mol/L}$×100%=75%,
故答案为:75%;
③平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案为:5.33;
④CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ/mol,
①反应消耗0.75mol/×2L=1.5mol,反应放热=$\frac{1.5mol×49KJ}{1mol}$=73.5KJ,
故答案为:73.5;
⑤CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ/mol,反应是气体体积较小的放热反应,
A.反应是放热反应,升高温度平衡逆向进行,故A错误;
B.再充入3mol H2 增大反应物浓度,平衡正向进行,故B正确;
C.将CH3OH (g)从体系中分离,减少生成物浓度平衡正向进行,故C正确;
D.充入He(g),使体系压强增大,但分压不变,平衡不变,故D错误;
故答案为:BC.
点评 本题考查较为综合,涉及热化学方程式书写、化学平衡计算以及平衡移动等问题,题目难度中等,注意根据图象计算各物质的平衡浓度为解答该题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 g]
g]查看答案和解析>>
科目:高中化学 来源: 题型:选择题
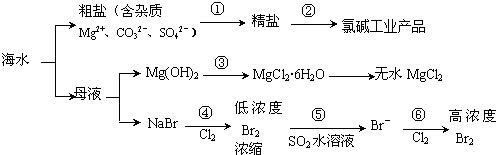
| A. | 过程①需要加入不止1种试剂,并通过合适的操作,方能把杂质除去 | |
| B. | 过程②得到的氯碱工业产品中只含有1种单质 | |
| C. | 过程③发生复分解反应 | |
| D. | 过程④、⑤、⑥均发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑦ | B. | ②⑥⑦ | C. | ①④⑧ | D. | ④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4<0,△H5>0 | |
| B. | △H6=$\frac{{△H}_{1}×3-{△H}_{2}-{△H}_{3}×2}{6}$ | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=$\frac{{△H}_{4}-{△H}_{3}}{2}$ | |
| D. | 2Fe3O4(s)+$\frac{1}{2}$O2(g)=3Fe2O3(s)△H=$\frac{{△H}_{4}-{△H}_{5}}{2}$-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 凡质子数相同的微粒,其化学性质一定相同 | |
| C. | 含氧酸可作氧化剂,无氧酸只作还原剂 | |
| D. | 元素的非金属性越强,其简单阴离子的还原性越弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com