
| A. | b+n | B. | b+a+n | C. | b+a-n | D. | b-a+n |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量与阿伏加德罗常数(NA)个磷酸分子的质量在数值上相等 | |
| B. | 常温常压下,0.5NA个CO分子所占体积是11.2L | |
| C. | 1molNH4+中含有的电子数为10NA | |
| D. | 1L0.3mol/L的Na2SO4溶液中,含有Na+和 SO42-总数为0.9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 密度/g.cm-3 | 硬度 | 导电性 | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| C. | 用蒸发结晶的方法从氧化后的海带灰浸取液中提取碘--蒸发皿 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
查看答案和解析>>
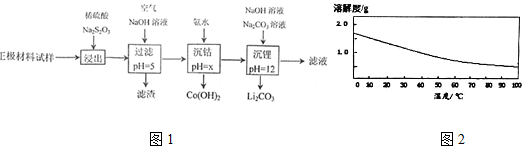
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C发生还原反应 | B. | 生成1molAlN转移3mol电子 | ||
| C. | N2是还原剂 | D. | AlN的摩尔质量为41g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com