
【题目】现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol.则原混合气体中氢气的物质的量可能是( )
A.0.03mol
B.0.04mol
C.0.05mol
D.0.06mol
【答案】BC
【解析】解:60mL2mol/L的NaOH溶液中含有氢氧化钠的物质的量为:2mol/L×0.06L=0.12mol,所得溶液中只含有2种溶质,溶质组成为:①NaOH和NaCl,②NaCl和NaClO,
当溶质为①NaOH和NaCl时,说明氯气不过量,氯元素完全转化成NaCl,根据氯元素守恒可知氯气的物质的量为:0.1mol× ![]() =0.05mol,则氢气的物质的量为0.05mol;
=0.05mol,则氢气的物质的量为0.05mol;
当溶质为②NaCl和NaClO时,说明氯气过量,氢氧化钠溶液完全反应,生成次氯酸钠的物质的量为:0.12mol﹣0.1mol=0.02mol,根据反应Cl2+2NaOH=NaCl+NaClO+H2O可知混合气体中与氢氧化钠溶液反应的氯气的物质的量为0.02mol,则参与反应H2+Cl2=2HCl、HCl+NaOH=NaCl+H2O的气体的物质的量为:0.1mol﹣0.02mol=0.08mol,所以氢气的物质的量为:0.08mol× ![]() =0.04mol;
=0.04mol;
根据分析可知,氢气的物质的量可能为0.04mol或0.05mol,
故选BC.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有两份组成及质量都相等的Na2O2和Na2CO3的混合物,向第一份中加入足量的稀硫酸,放出的气体共4.48L.将此气体通入第二份混合物,充分反应后,气体体积变为4.032L(均为标准状况下体积).则原混合物中Na2O2和Na2CO3的物质的量之比为( )
A.2:9
B.3:2
C.2:1
D.8:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的H2和CO2物质的量之比为__________,密度之比为______。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________L(用含NA的式子表示)。
(3)配制100 mL1mol·L-1的稀H2SO4溶液,需要用量筒量取一定体积的浓H2SO4(密度为1.84 g·mL-1、质量分数为98%),现有①10mL、②50mL、③100mL三种规格的量筒,应选用的量筒是________(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。

(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为____________________________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是_____________________________________ ,已知光照条件下D与F反应生成B,写出该反应的化学方程式:______________________________________
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列现象的化学用语正确的是( )
A.铁钉在空气中出现红色的铁锈,其负极反应式为:Fe﹣3e﹣═Fe3+
B.氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH ![]() ═Mg2++NH3?H2O
═Mg2++NH3?H2O
C.向足量铝粉与氢氧化钠溶液反应后的溶液中滴加碳酸氢钠溶液:HCO ![]() +AlO
+AlO ![]() +H2O═Al(OH)3↓+CO
+H2O═Al(OH)3↓+CO ![]()
D.漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO﹣+2H2O═Fe(OH)2↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由X、Z、Q三种元素组成。医学中常用QR溶液配制生理盐水。化合物乙由X、R两种元素组成。请回答下列问题:

(1)Q的离子结构示意图为_________。
(2)Y元素的单质及其化合物能发生如上图所示的转化,则Y元素在元素周期表中的位置__________,在甲溶液中通入少量YZ2气体,写出该反应的离子方程式:_______________。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为_________________________。
②下列表述中能证明Q的金属性强于W的是______(填序号)。
a.Q单质的熔点比W单质的低
b.W的原子序数大
c.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
d.将Q、W的单质置于水中,Q单质与水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]在一定条件下的转化如下图所示,下列说法正确的是
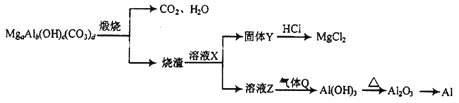
A. Q可能为NH3
B. X可能为NaOH
C. a、b、c、d符合关系式:2a+3b=c+2d
D. 工业上用CO还原Al2O3的方法制取金属Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的结构式为________
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_________。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为_____,通入b气体的电极反应式_______.(质子交换膜只允许H+通过)

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在_________左右。
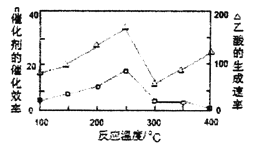
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_________
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( ) 
A.1 molH2中的化学键断裂时需要吸收436 kJ能量
B.2 molHCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为:H2(g)+Cl2(g)═2HCl(g)△H=+183 kJ/mol
D.此反应的热化学方程式为: ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g)△H=﹣91.5 kJ/mol
Cl2(g)═HCl(g)△H=﹣91.5 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com