
【题目】元素ⅹ位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子。X与Y形成的化合物的晶胞结构如图所示,下列关于该晶体的说法正确的是( )
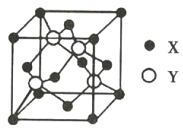
A.1个晶胞中所含离子总数为18
B.X2+的配位数为8,Y2-的配位数为4
C.与每个X2+距离最近且相等的X2+共有12个
D.该化合物的化学式为CaS
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=___kJ·mol-1。
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___。
N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___。
a.使用催化剂 b.降低温度 c.及时分离水
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:

①外电路电子移动方向:___。(填“a极到b极”或“b极到a极”)。
②a极电极反应式为___。
③若燃料电池消耗的空气在标准状况下的体积是22.4L(假设空气中O2体积分数为20%),则理论上消耗甲烷___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质:①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 、⑤
、⑤![]() 、⑥
、⑥![]() 、⑦
、⑦![]() 、⑧
、⑧![]() 和⑨
和⑨![]() 。
。
(1)只含有![]() 键的是__________(填序号,下同);
键的是__________(填序号,下同);
(2)既含有![]() 键又含有
键又含有![]() 键的是__________。
键的是__________。
(3)含有由两个原子的![]() 轨道重叠形成
轨道重叠形成![]() 键的是__________。
键的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1.00L浓度均为0.0100mol/L的Na2SO3、NaOH 混合溶液中通入HCl气体调节溶液pH(忽略溶液体积变化)。其中比H2SO3、HSO3-、SO32-平衡时的分布系数(各含硫物种的浓度与含硫物种总浓度的比)随HCl气体体积(标况下)的变化关系如图所示(忽略SO2气体的逸出);已知Ka1代表H2SO3在该实验条件下的一级电离常数。下列说法正确的是
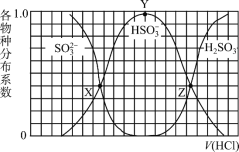
A.Z点处的pH=-lgKa1(H2SO3)
B.从X点到Y点发生的主要反应为SO32- +H2OHSO3- +OH-
C.当V(HCl)≥672mL时,c(HSO3-) = c(SO32-)=0mol/L
D.若将HCl改为NO2,Y点对应位置不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为NaCl和CsCl的晶体结构,下列说法错误的是( )
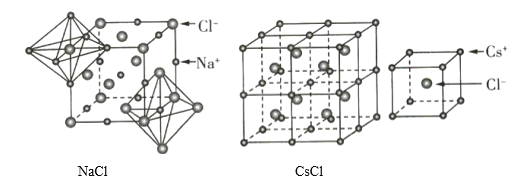
A.NaCl和CsCl都属于AB型的离子晶体
B.NaCl和CsC1晶体中阴、阳离子个数比相同,所以二者的阴、阳离子的配位数也相同
C.CsCl晶体中阴、阳离子的配位数均为8
D.NaCl和CsCl都属于AB型的离子晶体,但阴、阳离子的半径比不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___;
②a、b、c三点CO的转化率从大到小的顺序为___;a、c、d三点的平衡常数从大到小的顺序为___。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____(填化学式);A电极的电极反应式为____;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___(填“酸性”“碱性”或“中性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
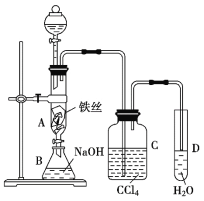
(1)反应后观察到A中反应液微沸,有红棕色气体充满A容器,写出A中反应的化学方程式__;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入__溶液,若产生淡黄色沉淀,则能证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2gSiH4自燃放出热量89.2kJ,其热化学方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是

A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com