
(9分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列
问题: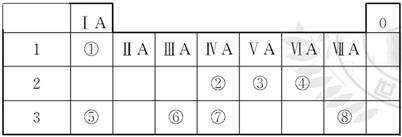
(1)④、⑤、⑥的原子半径由大到小的顺序是____________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_____________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_______________________________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3
(3)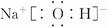 或
或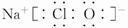 (4)a、b
(4)a、b
解析试题分析:根据元素所在周期表中的位置,可知元素的种类:①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素。
(1)Na与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Al,原子核外电子层数越多,半径越大,则有原子半径Na>Al>O。
(2)②、③、⑦对应的元素分别为C、N、Si,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3
(3))①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物,电子式分别为 、
、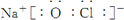
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,故答案为:ab。
考点:本题考查元素的推断、元素周期律与元素周期表、电子式。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:单选题
下列关于元素的叙述正确的是( )
| A.金属元素与非金属元素能形成共价化合物 |
| B.只有在原子中,质子数才与核外电子数相等 |
| C.目前使用的元素周期表中,最长的周期含有36种元素 |
| D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2和8 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
卤族元素随着原子序数的增大,下列递变规律正确的是( )
| A.原子半径逐渐增大 | B.单质的氧化性逐渐增强 |
| C.单质熔、沸点逐渐降低 | D.气态氢化物稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素, XW2是通常呈液态的有机物,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和。根据以上信息回答下列问题:(用元素符号或化学式等化学用语回答)
(1)XW2的电子式为 。
(2)Y原子中电子运动状态有 种, Z的气态氢化物在同主族元素气态氢化物中最高是因为 。
(3)Q在周期表中的位置 ,其基态原子简化电子排布式为 。交警可以用H2SO4酸化的K2 Cr2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。
请写出此原理的离子方程式 。
(4)含W的两种元素种类相同的酸式铵盐溶液反应的离子方程式
。
(5)某种燃料电池一极通乙醇的最简单同系物蒸气,一极通Z2,以NaOH溶液为电解液。请写出该原电池负极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)(1)写出氯原子的原子结构示意图
(2)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(3)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(4)请写出下列物质的电子式。H2O CO2 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:C ;E 。
(2)化合物A2D的电子式为 。
(3)元素B的一种同位素可测定文物年代,这种同位素的符号是 。
(4)B的最高价氧化物的结构式 。
(5)写出符合X2Y2的物质在MnO2催化作用下生成D单质的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是 ;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com