
【题目】碘在科研与生活中有重要应用,某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-= 2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的___耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为n(S2O32-)∶n(S2O82-)___。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx__mL,理由是___。
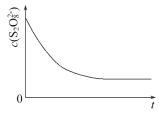
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)____
【答案】Na2S2O3 <2 2.0 保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的 
【解析】
(1)利用S2O82-+2I-=2SO42-+I2(慢)、 I2+2S2O32-= 2I-+S4O62-(快),进行判断;
(2)探究反应物浓度对化学反应速率的影响,需要只改变一种物质的浓度,而其它物质的浓度不变;
(3)降低温度,反应速率减慢;使用催化剂加快反应速率。
(1)已知S2O82-+2I-=2SO42-+I2(慢)、 I2+2S2O32-= 2I-+S4O62-(快),当S2O32-耗尽时,S2O82-与I-反应生成碘单质,淀粉遇到碘显蓝色,根据方程式,n(S2O32-)∶n(S2O82-)=2:1时恰好完全反应,为保证能观察到蓝色,则n(S2O32-)<2n(S2O82-);
(2)探究反应物浓度对化学反应速率的影响,需要只改变一种物质的浓度,而其它物质的浓度不变,为保持总体积不变,只改变一种物质的浓度,则Vx=2.0mL;
(3)降低温度,反应速率减慢,达到溶液显蓝色的时间变长;使用催化剂加快反应速率,达到溶液显蓝色的时间变短,图像为 。
。


科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是

A. A处通入空气,B处通入水煤气
B. a电极的反应式包括:CO+4OH--2e-= CO32-+2H2O
C. a电极发生还原反应,b电极发生氧化反应
D. 如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】橡皮筋在拉伸和收缩状态时结构如图:在其拉伸过程中有放热现象,反之吸热。25℃、101kPa时,下列化学反应的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是

A.2Na+2H2O=2NaOH+H2↑
B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
C.2H2+O2=2H2O
D.CaCO3=CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
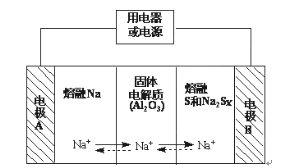
(1)请判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
A.常温 B.60℃~ 100℃ C.200℃~350℃ D.2000℃~3000℃
(2)放电时,电极A为___极。
(3)放电时,内电路中Na+的移动方向为___(填“从A到B”或“从B到A”)。
(4)充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为___。
Ⅱ、用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
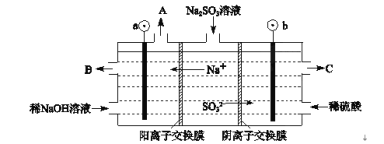
(1)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(2)SO32-放电的电极反应式为____。
(3)电解过程中阴极区碱性明显增强,请结合电极方程式解释原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验过程中,若一种气体极易溶于一种液体,则容易发生倒吸现象,给实验造成危险。现有4位同学分别设计了一个实验,希望通过观察到的明显现象来说明二氧化碳极易溶于氢氧化钠溶液,设计的装置如下:

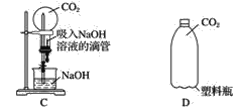
其中一位同学向充满二氧化碳的塑料瓶D中加入氢氧化钠溶液,盖紧瓶塞后振荡,如果看到瓶子变瘪了,说明二氧化碳与氢氧化钠溶液发生了反应。对装置A~C,将能达到实验目的的装置、操作方法和实验现象填入下表(可不填满):
_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣为原料制备KClO3的流程如图:
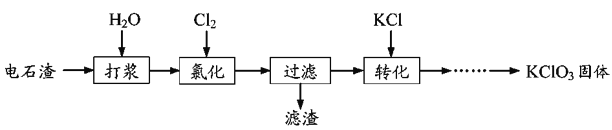
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
①滤渣的主要成分为_______(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n(CaCl2)___1:5(填“>”、“<”或“=”)。
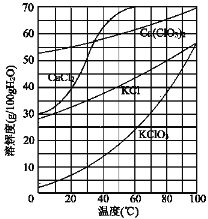
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100 gL-1,从该溶液中尽可能多地析出KClO3固体的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4 NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g),下列叙述正确的是
4NO(g)+6 H2O(g),下列叙述正确的是
A.NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O)
B.达到化学平衡时,4v正(O2)= 5v逆(NO )
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com