
【题目】下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是

A. A处通入空气,B处通入水煤气
B. a电极的反应式包括:CO+4OH--2e-= CO32-+2H2O
C. a电极发生还原反应,b电极发生氧化反应
D. 如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气4.48 L
【答案】D
【解析】
A.电子的流向可知,电子从a极出来,回到b极。所以a是负极(燃料失电子),b极是正极(O2得电子)。故A错误;
B.负极电极反应式:不仅CO失电子,还有H2失电子。CO失电子后变成+4价(以CO2形式存在)而电解质溶液是碱性溶液,所以CO2会与OH-发生反应生成CO32-。故电极反应为:CO+4OH--2e-= CO32-+2H2O。配平时不仅满足电子守恒,还有电荷守恒和原子守恒。同理可写出H2的反应:H2+2OH--2e-=2H2O。所以漏了H2的反应式。故B错误;
C.a电极是负极,发生氧化反应。b电极是正极,得到电子,发生还原反应。故C错误;
D.如用这种电池电镀铜,当镀件增重6.4gCu,说明n(Cu)=0.1mol。转移n(e-)=0.2mol。1molCO转移2mol e-,1mol H2转移2mol e-。1molCO和H2的混合气体也是转移2mol e-。现增重6.4gCu,转移0.2mol e-,所以消耗CO 0.1mol或0.1mol H2或CO和H2的混合气体0.1mol。故D正确。
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲。电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法不正确的是
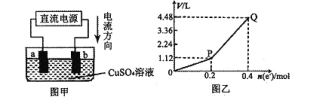
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b电极上发生的反应方程式为:4OH-一4e-=2H2O+O2↑
C.曲线O一P段表示H2的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种新型的汽车动力燃料。回答下列问题:
⑴工业上可通过![]() 和
和![]() 化合来制备甲醇。已知某些化学键的键能数据如下表:
化合来制备甲醇。已知某些化学键的键能数据如下表:
化学键 |
|
|
|
|
|
键能 | 413 | 436 | 358 | 1072 | 463 |
已知![]() 中的
中的![]() 与
与![]() 之间为三键,则工业制备甲醇的热化学方程式为________。
之间为三键,则工业制备甲醇的热化学方程式为________。
⑵某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为![]() 的密闭容器内充入
的密闭容器内充入![]() 和
和![]() ,加入合适催化剂(体积可以忽略不计),在
,加入合适催化剂(体积可以忽略不计),在![]() 时开始反应,并用压力计监测容器内压强的变化如下表:
时开始反应,并用压力计监测容器内压强的变化如下表:
反应时间/ | 0 | 5 | 10 | 15 | 20 | 25 |
压强/ | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到![]() 时,以
时,以![]() 表示的平均反应速率
表示的平均反应速率![]() ________,该温度下平衡常数
________,该温度下平衡常数![]() ________
________![]() ,若升高温度,则
,若升高温度,则![]() 值________(填“增大”“减小”或“不变")。
值________(填“增大”“减小”或“不变")。
⑶模拟工业合成甲醇的反应,下图是4种投料比![]() 分别为
分别为![]() 、
、![]() 、
、![]() 、
、![]() 下,反应温度对
下,反应温度对![]() 平衡转化率影响的曲线。
平衡转化率影响的曲线。

①曲线![]() 对应的投料比为________。
对应的投料比为________。
②当曲线![]() 、
、![]() 、
、![]() 对应的投料比达到相同的
对应的投料比达到相同的![]() 平衡转化率时,对应的反应温度与投料比的关系是________。
平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为![]() 、反应温度为
、反应温度为![]() 时,平衡混合气中
时,平衡混合气中![]() 的物质的量分数是________(精确到
的物质的量分数是________(精确到![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参素(I)是一种具有改善心脏功能、抗血栓形成、促进组织的修复与再生等多种作用的药物。该药物的一种合成路线如下:
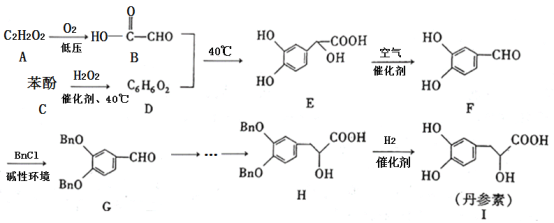
已知:![]() 代表苄基(
代表苄基(![]() )
)
请回答下列问题:
(1)![]() 的结构简式为_______,
的结构简式为_______,![]() 中所含官能团的名称为羟基、______。
中所含官能团的名称为羟基、______。
(2)![]() 的反应类型为_______,该反应的目的是________。
的反应类型为_______,该反应的目的是________。
(3)写出![]() 的化学方程式:________。
的化学方程式:________。
(4)苯酚与![]() 反应可以制备物质
反应可以制备物质![]() (
(![]() )。
)。![]() 是
是![]() 的同系物,相对分子质量比
的同系物,相对分子质量比![]() 大14。则符合下列条件的
大14。则符合下列条件的![]() 的同分异构体有______种(不考虑立体异构)。
的同分异构体有______种(不考虑立体异构)。
①苯环上只有两个取代基 ②能与![]() 溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
其中核磁共振氢谱有6组峰,且峰面积之比为![]() 的结构简式为________(写出一种即可)。
的结构简式为________(写出一种即可)。
(5)参照丹参素的上述合成路线,以![]() 为原料,设计制备
为原料,设计制备![]() 的合成路线:____________。
的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
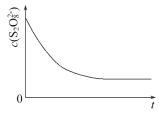
【题目】碘在科研与生活中有重要应用,某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-= 2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的___耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为n(S2O32-)∶n(S2O82-)___。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx__mL,理由是___。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知:2CH3CHO 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com