
下列关于一部分单质和氧化物、酸、碱、盐分类的说法正确的是
①纯碱②硝酸铜③食盐④硝酸⑤盐酸⑥硫酸钠⑦硫酸⑧火碱⑨生石灰⑩氯气
A、含氧酸盐有①②③⑥
B、①和⑧是同一种物质
C、可以把⑥归类为: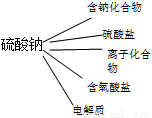
D、不能把⑦和⑧归为一类物质
科目:高中化学 来源:2016届山东师大附中高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列有关分类和氧化还原的描述正确的是( )
A.酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系
B.纯碱、烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应
C.得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性
D.元素的单质可由氧化或还原含该元素的化合物来制得
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高二上学期期中测试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
A.放电时负极反应为:3Zn-6e-+6OH-==3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O
FeO42- +4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.充电时阴极溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:填空题
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
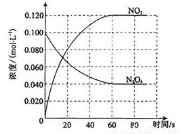
回答下列问题:
(1)反应的△H__________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,平均反应速率v(NO2)为__________mol?L-1?s-1,反应的平衡常数K为_____________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 mol?L-1?s-1的平均速率降低,经10s又达到平衡。则T___________100℃(填“>”或“<”)。
(3)100℃时达到平衡后, 继续往容器中通入0.1 N2O4 mol,则化学平衡_________(填“左移”、“右移”或“不移动”),达到新平衡时N2O4 的浓度________0.04mol/L。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:实验题
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
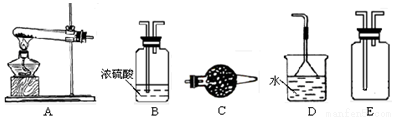
(1)实验空制取、收集干燥的NH3,需选用上述仪器装置中的 , 所用干燥剂的名称为 。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,写出制纳米级碳酸钙的化学方程式: 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级(1nm-100nm之间): 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三上学期统练(三)化学试卷(解析版) 题型:选择题
在298 K、101.325 kPa时发生下列反应:①2H2(g)+O2(g)=2H2O(l) ②CaO(s)+CO2(g)=CaCO3(s);其熵变分别为ΔS1和ΔS2,则下列情况中正确的是
A.ΔS1>0,ΔS2>0 B.ΔS1<0,ΔS2<0
C.ΔS1<0,ΔS2>0 D.ΔS1>0,ΔS2<0
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第四次考试化学试卷(解析版) 题型:实验题
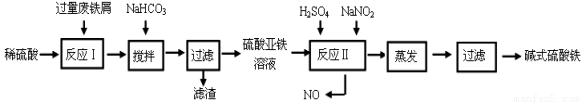
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 | 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 离子沉淀。
(2)反应Ⅱ中加入NaNO2,反应的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.K3Fe(CN)6溶液
查看答案和解析>>
科目:高中化学 来源:2016届江西上高第二中学高三12月月考理科综合化学试卷(解析版) 题型:填空题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
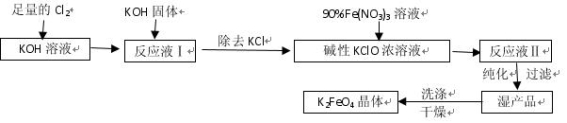
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)在“反应液I”中加KOH固体的目的是 :
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性
B.33.6LCl2一定能与56g铁在加热条件下发生反应
C.12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
D.在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有21NA个电子发生转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com