
����Ŀ�����Ȼ���������ýȾ����������ͼ��ʾװ�ÿ����Ʊ����Ȼ���(���ּг�װ����ȥ)��
�й���Ϣ���±�

�ش��������⣺
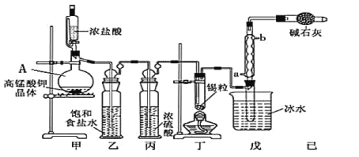
(1)��װ��������A������Ϊ_________��
(2)�ü�װ����������MnO4-����ԭΪMn2+���÷�Ӧ�����ӷ���ʽΪ_____________��
(3)��װ����ͼ���Ӻã���������ԣ���������Ũ���ᣬ���۲쵽______��������ʼ���ȶ�װ�ã����ۻ����ʵ����������������������ȶ�װ�ã���ʱ�������ȶ�װ�õ�Ŀ���ǣ� �ٴٽ�����������Ӧ�� ��_________��
(4)��װ�õ����� __________�����ȱ����װ�ã����ܷ����ĸ���Ӧ�Ļ�ѧ����ʽΪ___________����װ�õ�������__________������ţ�
A.��ֹ������CO2���������װ��
B.��ȥδ��Ӧ����������ֹ��Ⱦ����
C.��ֹˮ����������װ�õ��Թ���ʹ����ˮ��
D.��ֹ������O2������װ�õ��Թ���ʹ��������
(5)��Ӧ����ȥ����1.19g����Ӧ������װ�õ��Թ����ռ���2.04g SnCl4����SnCl4�IJ���Ϊ________��������2λ��Ч���֣�
���𰸡�������ƿ 2MnO4-+16H++10Cl-=2Mn2++5Cl2��+8H2O ��װ���ڳ�������ɫ���� ʹSnCl4���������ڴӻ�����з������ ��ȥ�����е��Ȼ��� Sn+2HCl=SnCl2+H2�� BC 78%
��������
�ڼ�װ�����ø�����ؾ�����Ũ���ᷴӦ��ȡ������ͨ����װ�ó�ȥ�����л��е�HCl���ʣ�Ȼ���ڱ�װ���и����������ڶ�װ����Cl2��Sn��Ӧ��ȡSnCl4��SnCl4����ˮ�⣬Ӧ����ˮ�����½��н��У���Ӧ����SnCl4Ϊ��̬�����촦�����ռ��õ�Һ̬SnCl4��������м�ʯ������δ��Ӧ����������ֹ��Ⱦ������ͬʱ���տ����е�ˮ��������ֹ�����ռ�SnCl4���Թ�ʹ��ˮ�⣬�Դ˽����⡣
(1)������װ��ͼ��֪AΪ������ƿ��
(2)A�з�����Ӧ��2KMnO4+16HCl(Ũ)=2KCl+2MnCl2+5Cl2��+8H2O�����ӷ���ʽΪ2MnO4-+16H++10Cl-=2Mn2++5Cl2��+8H2O��
(3)������װ���г�������ʱ������װ�ó�������ɫ���壬�ټ����ۻ������ϳ�SnCl4�����ȶ�װ�ã��ٽ�����������Ӧ��ʹ���ɵ�SnCl4�����������ڴӻ�����з���������������촦��ȴ�ռ���
(4)��װ�õ������dz�ȥCl2�е�����HCl���壬���ȱ����װ�ã����ܲ����ĺ���ǣ�HCl��Sn��Ӧ������Sn+2HCl=SnCl2+H2��������SnCl4���ʽ��ͣ���������������Ӧ���ܷ�����ը����װ����װ�м�ʯ�ң��������ǣ�����δ��Ӧ����������ֹ��Ⱦ������ͬʱ���տ����е�ˮ��������ֹ�����ռ�SnCl4���Թ�ʹ��ˮ�⣬��ѡ����������BC��
(5)��Ӧ����Sn��������1.19g�������ʵ���n(Sn)=![]() =0.01mol������Snԭ���غ㣬����������SnCl4���ʵ���Ϊ0.01mol����SnCl4�IJ���Ϊ
=0.01mol������Snԭ���غ㣬����������SnCl4���ʵ���Ϊ0.01mol����SnCl4�IJ���Ϊ![]() =78%��
=78%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǻ�ˮ������ɵ���ˮ������ˮ����ʱ���������������ߵ��η�(����NaClΪ��)��±֭����ʽ�����ڱ���֮�䣬�γɡ����ݡ�������½ṹ��ͼ��ʾ���������ı���ﵽ1�����ϣ����ڻ����ˮΪ��ˮ����NA��ʾ�����ӵ�������ֵ��������ܶ�Ϊ0.9g/cm3������������ȷ����

A.�����ڲ㡰���ݡ�Խ�٣��ܶ�Խ��
B.��������Խ�̣��ڲ�ġ����ݡ�Խ��
C.�����ܶȱ�ˮС����Ϊ�ڹ�̬����ˮ���Ӽ��������ϣ����и�����
D.ÿ��1mol H2O�ĺ����ھ���2��105 NA��NaCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ni2���붡��ͪ������ʺ�ɫ����ͪ����������÷�Ӧ�����ڼ���Ni2����
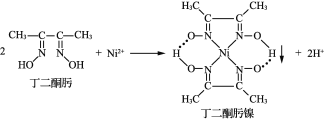
(1)Ni2����̬��������Ų�ʽΪ___________��
(2)1mol����ͪ뿷����к�����������ĿΪ______mol��
(3)����ͪ���������̼ԭ�ӵ��ӻ��������Ϊ_____��
(4)Ni(CO)4��һ����ɫҺ�壬�е�Ϊ43�棬�۵�Ϊ��19.3 �档Ni(CO)4�ľ���������____��
(5)��CO��Ϊ�ȵ�����Ķ���������Ϊ_____��Ni(CO)4��Ni��CO��Cԭ���γ���λ���������ǿռ乹�ͣ�Ni(CO)4�Ľṹ����ʾ��ͼ��ʾΪ_____��
(6)�������ӵ�VSEPRģ�������ӵĿռ����幹��һ�µ���_______��
A.SO32- B.ClO4- C.NO2- D.ClO3-
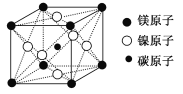
(7)������֣�ֻ��þ������̼����Ԫ�صľ��徹ȻҲ���г����ԡ�����������Ԫ�ض��dz���Ԫ�أ��Ӷ�����㷺��ע�������ͳ��������һ��������ͼ��ʾ����þ���Ļ�ѧʽΪ______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ó�Ϊ�����о����ȵ㣬�����͵���з�����Ҫ�IJ��ϡ�
��1��ͨ�����·�Ӧ�Ʊ���������
��Ӧ1��Al2O3(s)��AlCl3(g)��3C(s)=3AlCl(g)��3CO(g)����H1��akJ��mol��1
��Ӧ2��Al2O3(s)��3C(s)=2Al(l)��3CO(g)����H2��bkJ��mol��1
��Ӧ3��3AlCl(g)=2Al(l)��AlCl3(g)����H3
�ԱȽ�a��b�Ĵ�С����˵�����ɣ�a___b��������___��
��2���ڸ��������½��з�Ӧ��2Al(l)��AlCl3(g)![]() 3AlCl(g)��
3AlCl(g)��
����ͼ1��ʾ�ĵ��ݻ�A��B�ܱ������м���������Al�ۣ��ٷֱ����1molAlCl3(g)������ͬ�ĸ����½��з�Ӧ��ͼ2��ʾA�����ڵ�AlCl3(g)���������ʱ��ı仯ͼ����ͼ2�л���B������AlCl3(g)���������ʱ��ı仯���ߡ�___
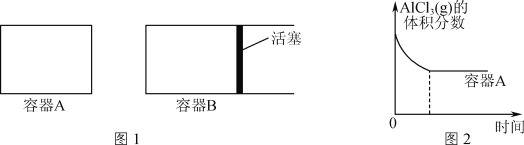
��1100��ʱ����2L�ܱ�������ͨ��3molAlCl(g)��������Ӧ��3AlCl(g)![]() 2Al(l)��AlCl3(g)����֪���¶���AlCl(g)��ƽ��ת����Ϊ80%����÷�Ӧ��ƽ�ⳣ��K��___��
2Al(l)��AlCl3(g)����֪���¶���AlCl(g)��ƽ��ת����Ϊ80%����÷�Ӧ��ƽ�ⳣ��K��___��
�ۼ���3molAlCl(g)���ڲ�ͬѹǿ�·�����Ӧ���¶ȶԲ��ʵ�Ӱ����ͼ3��ʾ���˷�Ӧѡ���¶�Ϊ900���ԭ����___���о����������¶ȴﵽ2500������ʱ��ͼ�������غϣ��Է�������ԭ��___��
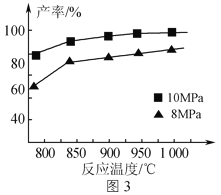
��3�����������Ŀ��ٷŵ������Ӷ��ε�ص�ԭ����ͼ4��ʾ���õ�س��ʱ�������ĵ缫��ӦʽΪ___��
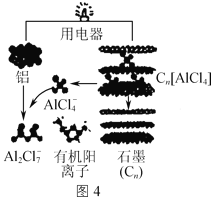
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ú������ʣ�FeO��Fe2O3���ķ�CuO�Ʊ��������壬���������й��̣���֪ Fe3+�� pH=5ʱ������ȫ�������з����������
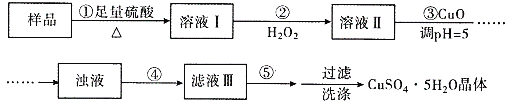
A. ����ڷ�������Ҫ��ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O
B. ����ڲ�������ˮ�������ǿ����������H2O2
C. �����Ϊ���ˣ�����������ᾧ
D. ������� CuCO3����CuOҲ�ɵ�����Һ��pH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ�������ƻ�������������ܿ�����Ԥ�ڵ��������й���ʵ������ķ�������ȷ���ǣ� ��
ѡ�� | A | B | C | D |
װ�� |
|
|
|
|
���� | ��Ͳ��δ������״Һ�� | �Թ����к�ɫ��������δ�������� | �Թ���δ������ɫ���� | NaOH��ҺҺ���� δ������״Һ�� |
ԭ�� | ����������δ��Ӧ | ��Ӧδ���ɵ����� | ����Ũ�� �ϴ� | ����ˮ�� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ�ҩ���첫��·����ijһ�������£�

����˵����ȷ���ǣ� ��
A. ����X�ڿ����в��ױ�����
B. ����Z�ķ���ʽΪC13H14O3
C. ����Y���Է���ȡ�����ӳɡ���ȥ��Ӧ
D. �����ʵ�����Y��Z�ֱ���NaOH��Һ��Ӧ���������NaOH�����ʵ���֮��Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ƽ���ҽ���ϳ�������������ۣ���һ�ֺϳ�·����ͼ��
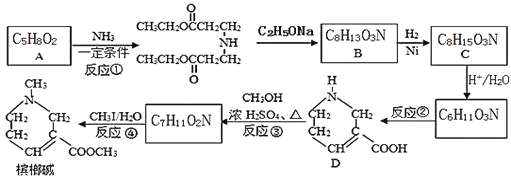
��֪�������ͻ������백��NH3����R��NH2����Ӧ�������µİ�������磺R1��CH=CH2+R2��NH2![]() R1��CH2��CH2��NH��R2
R1��CH2��CH2��NH��R2
��![]() +
+![]()
![]()
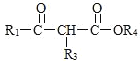 + R2OH
+ R2OH
��1��B�ĺ�������������Ϊ_______________��
��2����Ӧ�ڢܵķ�Ӧ���ͷֱ�Ϊ______________��______________��
��3����Ӧ�۵Ļ�ѧ����ʽΪ___________________��
��4��A��C�Ľṹ��ʽ�ֱ�Ϊ_____________��_______________��
��5��A��ͬ���칹�������������������� _______ �֣������������칹����
a����������NaHCO3��Һ��Ӧ�ų�CO2����Ĺ����ţ�
b����ʹ���CCl4��Һ��ɫ��
��6�����������Ϣ�����Ҷ���Ϊ��Ҫԭ�ϣ��������Լ���ѡ��д���ϳ�![]() �����·��____________��
�����·��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��5��9���й���ѧԺ��ʽ����ᷢ��113�š�115�š�117�ź�118��Ԫ�ص��������ơ���֪117��Ԫ���ж���ԭ�ӣ���![]() ��
��![]() �ȡ�����˵����ȷ����
�ȡ�����˵����ȷ����
A. ![]() ��
��![]() �Ļ�ѧ������ȫ��ͬ
�Ļ�ѧ������ȫ��ͬ
B. Ԫ��Ts�����ԭ������Ϊ![]()
C. ��̬![]() ԭ�Ӻ�����ӹ�ռ��7���ܼ�
ԭ�Ӻ�����ӹ�ռ��7���ܼ�
D. Tsλ�����ڱ��ĵ������ڢ�A��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com