
【题目】A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g)![]() cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min |
0.12 | 0.06 | 0.10 | t1 |
0.06 | 0.12 | 0.20 | t2 |
A. 0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B. 若起始时n(D)=0,则t2时刻v(D)=0.20/t2 mol·(L·min)-1
C. 升高温度,v(B)、v(C)、v(D)均增大
D. b∶d=6∶1
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
①取一定量的该烃,使其充分燃烧后的气体通过装有CaCl2干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。
②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
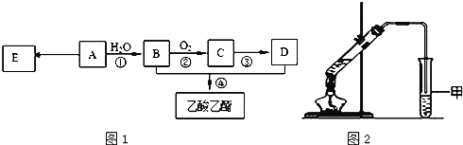
(1)0.1mol该烃A能与 _____g溴发生加成反应;加成产物需 _____mol溴蒸气完全取代;
(2)B中官能团的名称是_____, B可通过加入强氧化剂为_______(任填一种)一步直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式______;合成E的反应类型______;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________;
②上述实验中饱和碳酸钠溶液的作用是________;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是_____。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应5H2C2O4+2MnO4-+6H+===10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是
A. 实验①、②、③所加的H2C2O4溶液均要过量
B. 实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
C. 若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液和胶体的叙述中错误的是
A.溶液是混合物,胶体是纯净物B.胶体粒子的直径为10-9~10-7m
C.溶液和胶体均呈电中性D.利用丁达尔效应可区分溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,从海带里提取碘的部分流程如下图,下列说法不正确的是

A. 步骤①灼烧海带需要用坩埚
B. 步骤③主要操作为过滤
C. 步骤④主要反应为:2I-+H2O2+2H+=2H2O+I2
D. 步骤⑤可以加入酒精萃取I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中,发生反应:H2(g)+CO(g)![]() C(s)+H2O(g),初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法正确的是
C(s)+H2O(g),初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法正确的是
A. 当气体的平均相对分子质量为16时该反应达平衡B. 此时CO的转化率为40%
C. 反应前后气体的密度之比为5∶4D. 反应前后气体的压强之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子的易溶盐。以卤块为原料可制得轻质氧化镁,工艺流程如图:
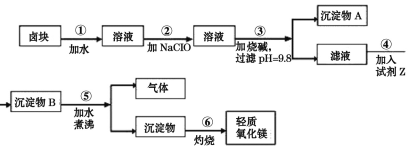
已知:(1)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(2)原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(3)生成氢氧化物沉淀的PH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
回答下列问题:
(1)某课外兴趣小组设计实验证明卤块中含有Fe3+为:取少许样品加水溶解,____,则说明卤块中含Fe3+。
(2)工业上冶炼镁常用的方法的化学方程式为____。
(3)步骤②加入NaClO而不用H2O2的原因是____,步骤②反应后产生少量红褐色沉淀,该反应中氧化剂与还原剂的比例为____。
(4)沉淀A的主要成分为____;步骤④加入的物质为____。
(5)步骤⑤发生的反应的化学方程式为____。
(6)步骤⑥如在实验室进行,应选用在____(填仪器名称)中灼烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1)重结晶仅适用于固体有机物的分离和提纯。(_____)
(2)可以用酒精作萃取剂萃取溴水中的溴。(_____)
(3)萃取法只适用于从液体中萃取物质。(_____)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学反应方程式,并判断其反应类型(加成、取代、氧化)
①甲烷与氯气反应_______________________________,属于________反应
②乙烯通入溴水:_________________________________,属于________反应
③乙醇与金属钠反应:__________________________________,属于________反应
④由苯制取硝基苯:_______________________________,属于________反应;
⑤灼热的铜丝多次反复地插入乙醇中:___________________,属于_______反应;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com