
ΓΨΧβΡΩΓΩΕΧ÷ήΤΎ‘ΣΥΊAΓΔBΓΔXΓΔYΓΔZ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΘ§A‘ΣΥΊΥυ¥ΠΒΡ÷ήΤΎ ΐΓΔ÷ςΉε–ρ ΐΓΔ‘≠Ή”–ρ ΐΨυœύΒ»Θ§BΒΡΤχΧ§«βΜ·Έο «Χλ»ΜΤχΒΡ÷ς“Σ≥…Ζ÷Θ§YΒΡΉνΆβ≤ψΒγΉ” ΐ «ΤδΡΎ≤ψΒγΉ” ΐΒΡ3±Ε Θ§ZΒΞ÷ Ω…÷Τ≥…ΑκΒΦΧε≤ΡΝœΘ§BΓΔZΆ§÷ςΉεΓΘ
ΔΌ–¥≥ωZΒΡ‘≠Ή”ΫαΙΙ Ψ“βΆΦ_______________________ΓΘ
ΔΎ‘ΣΥΊY‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷Ο________________________ΓΘ
ΔέA”κXΩ…–Έ≥…ΒγΉ”Ήή ΐΈΣ10ΒΡΈΔΝΘΘ§Τδ÷––Έ≥…ΒΡΖ÷Ή”ΒΡΫαΙΙ ΫΈΣ_______________Θ§–Έ≥…ΒΡάκΉ”ΒΡΜ·―ß ΫΈΣ_________________ΓΘ
ΔήΫœΜ·ΚœΈοBY2”κZY2ΒΡ»έΒψΗΏΒΆΘΚ___________ΘΨ___________Θ®ΧνΜ·―ß ΫΘ©Θ§“ρΈΣZY2 τ”Ύ________ΨßΧεΘ®ΧνΨßΧεάύ–ΆΘ©Θ§»έΜ· ±–ηΤΤΜΒ___________Θ®ΧνΓΑΙ≤ΦέΦϋΓ±ΓΔΓΑάκΉ”ΦϋΓ±ΜρΓΑΖ÷Ή”ΦδΉς”ΟΝΠΓ±Θ©ΓΘ
ΓΨ¥πΑΗΓΩ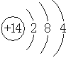 ΒΎΕΰ÷ήΤΎ ΔωAΉε
ΒΎΕΰ÷ήΤΎ ΔωAΉε ![]() NH4+ SiO2 CO2 ‘≠Ή” Ι≤ΦέΦϋ
NH4+ SiO2 CO2 ‘≠Ή” Ι≤ΦέΦϋ
ΓΨΫβΈωΓΩ
ΕΧ÷ήΤΎ‘ΣΥΊAΓΔBΓΔXΓΔYΓΔZ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΘ§A‘ΣΥΊΥυ¥ΠΒΡ÷ήΤΎ ΐΓΔ÷ςΉε–ρ ΐΓΔ‘≠Ή”–ρ ΐΨυœύΒ»Θ§‘ρA «H‘ΣΥΊΘ§BΒΡΤχΧ§«βΜ·Έο «Χλ»ΜΤχΒΡ÷ς“Σ≥…Ζ÷Θ§‘ρB «C‘ΣΥΊΘ§YΒΡΉνΆβ≤ψΒγΉ” ΐ «ΤδΡΎ≤ψΒγΉ” ΐΒΡ3±ΕΘ§ΉνΆβ≤ψΒγΉ” ΐ–Γ”Ύ8Θ§Υυ“‘Y «O‘ΣΥΊΘ§XΒΡ‘≠Ή”–ρ ΐ¥σ”ΎBΕχ–Γ”ΎYΘ§Υυ“‘X «N‘ΣΥΊΘ§ZΒΞ÷ Ω…÷Τ≥…ΑκΒΦΧε≤ΡΝœΘ§BΓΔZΆ§÷ςΉεΘ§‘ρZ «Si‘ΣΥΊΘ§‘ΌΫαΚœΈο÷ ΫαΙΙΓΔ–‘÷ Ϋβ¥πΓΘ
ΔΌZ «Si‘ΣΥΊΘ§Τδ‘≠Ή”ΚΥΆβ”–3ΗωΒγΉ”≤ψΓΔΉνΆβ≤ψΒγΉ” ΐ «4Θ§Υυ“‘Τδ‘≠Ή”ΫαΙΙ Ψ“βΆΦΈΣΘΚ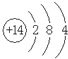 ΘΜ
ΘΜ
ΔΎY «OΘ§O‘≠Ή”ΚΥΆβ”–2ΗωΒγΉ”≤ψΓΔΉνΆβ≤ψΒγΉ” ΐ «6Θ§Υυ“‘O‘ΣΥΊΈΜ”ΎΒΎΕΰ÷ήΤΎΔωAΉεΘΜ
ΔέA”κXΩ…–Έ≥…ΒγΉ”Ήή ΐΈΣ10ΒΡΈΔΝΘ «NH3Θ§N‘≠Ή”ΚΆΟΩΗωH‘≠Ή”÷°Φδ¥φ‘Ύ“ΜΗωΙ≤ΦέΦϋΘ§ΤδΫαΙΙ ΫΈΣ![]() Θ§–Έ≥…ΒΡοßΗυάκΉ”Μ·―ß ΫΈΣNH4+ΘΜ
Θ§–Έ≥…ΒΡοßΗυάκΉ”Μ·―ß ΫΈΣNH4+ΘΜ
ΔήZ «Si‘ΣΥΊΘ§B «C‘ΣΥΊΘ§Y «O‘ΣΥΊΘ§BY2ΈΣCO2Θ§ZY2ΈΣSiO2Θ§Εΰ―θΜ·Ιη τ”Ύ‘≠Ή”ΨßΧεΓΔΕΰ―θΜ·ΧΦΙΧΧε τ”ΎΖ÷Ή”ΨßΧεΘ§‘≠Ή”ΨßΧε»έΒψΗΏΘ§Ζ÷Ή”ΨßΧεΒΡ»έΒψΒΆΘ§‘ρCO2ΒΡ»έΒψΒΆ”ΎSiO2Θ§Ζ÷Ή”ΨßΧε»έΜ· ±ΤΤΜΒΖ÷Ή”ΦδΉς”ΟΝΠΘ§‘≠Ή”ΨßΧε»έΜ· ±–η“ΣΤΤΜΒΙ≤ΦέΦϋΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ(1)““»≤ΒΡΒγΉ” Ϋ__________________ΓΘ
(2)![]() Ζ÷Ή” ΫΘΚ_________________ΓΘ
Ζ÷Ή” ΫΘΚ_________________ΓΘ
(3)![]() Τδ±ΫΜΖ…œΒΡ“Μ¬»¥ζΈο”–______÷÷
Τδ±ΫΜΖ…œΒΡ“Μ¬»¥ζΈο”–______÷÷
(4)ΫαΙΙΦρ ΫΈΣ![]() ¥ΥΧΰΟϊ≥ΤΈΣ___________________ΓΘ
¥ΥΧΰΟϊ≥ΤΈΣ___________________ΓΘ
(5) 4Θ§4Θ§5©¹»ΐΦΉΜυ©¹2©¹ΦΚ»≤(–¥≥ωΫαΙΙΦρ Ϋ)ΓΓ____________ΓΘΓΓ
(6)ΫαΙΙΦρ ΫΈΣ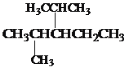 ΒΡΧΰΩ…ΟϋΟϊΈΣΘΚ____________________ΓΘΓΓ
ΒΡΧΰΩ…ΟϋΟϊΈΣΘΚ____________________ΓΘΓΓ
(7)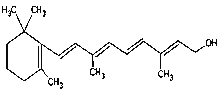 1molΗΟΈο÷ œϊΚΡ_______molH2.
1molΗΟΈο÷ œϊΚΡ_______molH2.
(8)Φχ±π±ΫΘ§ΒβΜ·ΦΊ»ή“ΚΘ§œθΥα“χ»ή“ΚΘ§ΦΚœ©Θ§ΥΡ¬»Μ·ΧΦ ±Θ§÷ΜΡή”Ο“Μ÷÷ ‘ΦΝΘ§ΗΟ ‘ΦΝ «_________ΘΜ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡή±μ ΨH2(g)+ I2(g)![]() 2HI(g)“―Ψ≠¥οΒΫΤΫΚβΉ¥Χ§ΒΡ±ξ÷Ψ «Θ® Θ©
2HI(g)“―Ψ≠¥οΒΫΤΫΚβΉ¥Χ§ΒΡ±ξ÷Ψ «Θ® Θ©
ΔΌc(H2)=c(I2)=c(HI) ±
ΔΎc(H2)ΘΚc(I2)ΘΚc(HI)=1ΘΚ1ΘΚ2 ±
Δέc(H2)ΓΔc(I2)ΓΔc(HI)≤Μ‘ΌΥφ ±ΦδΕχΗΡ±δ
ΔήΒΞΈΜ ±ΦδΡΎ…ζ≥…nmolH2ΒΡΆ§ ±…ζ≥…2nmolHI
ΔίΒΞΈΜ ±ΦδΡΎ…ζ≥…nmolH2ΒΡΆ§ ±…ζ≥…nmolI2
ΔόΖ¥”ΠΥΌv(H2)=v(I2)=1/2v(HI)
ΔΏ“ΜΗωH-HΦϋΕœΝ―ΒΡΆ§ ±”–ΝΫΗωH-IΦϋΕœΝ―
ΔύΈ¬Ε»ΚΆΧεΜΐ“ΜΕ® ±Θ§»ίΤςΡΎ―Ι«Ω≤Μ‘Ό±δΜ·
ΔαΈ¬Ε»ΚΆΧεΜΐ“ΜΕ® ±Θ§ΜλΚœΤχΧεΒΡ―’…Ϊ≤Μ‘Ό±δΜ·
ΔβΈ¬Ε»ΚΆ―Ι«Ω“ΜΕ® ±Θ§ΜλΚœΤχΧεΒΡΟήΕ»≤Μ‘Ό±δΜ·
ΧθΦΰ“ΜΕ®Θ§ΜλΚœΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ≤Μ‘Ό±δΜ·
A.ΔέΔήΔΏΔαΔβB.ΔέΔήΔΏΔαC.ΔΎΔέΔήΔΏΔαD.ΔΎΔέΔήΔόΔΏΔα
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Υ°ΫβΖΫ≥Χ ΫΒΡ ι–¥≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A.NH4+ΘΪH2O![]() NH3ΓΛH2OΘΪHΘΪ
NH3ΓΛH2OΘΪHΘΪ
B.S2Θ≠ΘΪ2H2O![]() H2SΘΪ2OHΘ≠
H2SΘΪ2OHΘ≠
C.CH3COONa+H2O![]() CH3COOH+NaOH
CH3COOH+NaOH
D.MgCO3 + H2O![]() Mg(OH)2 + CO2
Mg(OH)2 + CO2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒγΫβ÷ »ή“ΚΒΡΒγΒΦ¬ ‘Ϋ¥σΘ§ΒΦΒγΡήΝΠ‘Ϋ«ΩΓΘ”Ο0.1molΓΛLΘ≠1ΒΡNaOH»ή“ΚΖ÷±πΒΈΕ®ΧεΜΐΨυΈΣ10.00mLΓΔ≈®Ε»ΨυΈΣ0.1molΓΛLΘ≠1ΒΡ―ΈΥαΚΆCH3COOH»ή“ΚΘ§άϊ”Ο¥ΪΗ–Τς≤βΒΟΒΈΕ®Ιΐ≥Χ÷–»ή“ΚΒΡΒγΒΦ¬ »γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
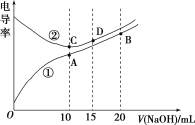
A.«ζœΏΔΌ¥ζ±μΒΈΕ®CH3COOH»ή“ΚΒΡ«ζœΏ
B.AΒψ»ή“Κ÷–ΘΚc(CH3COOΘ≠)ΘΪc(OHΘ≠)Θ≠c(HΘΪ)ΘΫ0.05molΓΛLΘ≠1
C.‘ΎœύΆ§Έ¬Ε»œ¬Θ§AΓΔBΓΔC»ΐΒψ»ή“Κ÷–Υ°ΒγάκΒΡc(HΘΪ)ΘΚB<AΘΫC
D.DΒψ»ή“Κ÷–ΘΚc(ClΘ≠)ΘΫ2c(OHΘ≠)Θ≠2c(HΘΪ)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ“ΜΕ®Έ¬Ε»œ¬Θ§œρ2 LΚψ»ίΟή±’»ίΤς÷–≥δ»κ1 mol AΘ§ΖΔ…ζA(g)![]() B(g) + C(g)Ζ¥”ΠΓΘΖ¥”ΠΙΐ≥Χ÷–c(C) Υφ ±Φδ±δΜ·ΒΡ«ζœΏ»γœ¬ΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
B(g) + C(g)Ζ¥”ΠΓΘΖ¥”ΠΙΐ≥Χ÷–c(C) Υφ ±Φδ±δΜ·ΒΡ«ζœΏ»γœ¬ΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «

A.Ζ¥”Π‘Ύ0 ~50 sΒΡΤΫΨυΥΌ¬ v(C) =1.6ΓΝ10-3mol/(LΓΛs)
B.ΗΟΈ¬Ε»œ¬Θ§Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐK = 0.025
C.±Θ≥÷ΤδΥϊΧθΦΰ≤Μ±δΘ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβ ±c(B)=0.11mol/LΘ§‘ρΗΟΖ¥”ΠΒΡΠΛH<0
D.Ζ¥”Π¥οΤΫΚβΚσΘ§‘Όœρ»ίΤς÷–≥δ»κ1 mol AΘ§ΗΟΈ¬Ε»œ¬‘Ό¥οΒΫΤΫΚβ ±Θ§0.1 mol/L<c(C)<0.2 mol/L
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥ Β―ι–ΓΉιάϊ”Οœ¬ΆΦΉΑ÷Ο÷Τ»Γ…ΌΝΩ¬»Μ·¬ΝΘ§“―÷Σ¬»Μ·¬Ν»έΖ–ΒψΕΦΚήΒΆ(178Γφ…ΐΜΣ),«““ΉΥ°ΫβΓΘœ¬Ν–ΥΒΖ®÷–Άξ»Ϊ’ΐ»ΖΒΡ“ΜΉι «
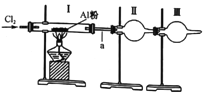
ΔΌ¬»Τχ÷–Κ§ΒΡΥ°’τΤχΚΆ¬»Μ·«βΩ…Ά®Ιΐ Δ”–ΩΝ–‘ΡΤΒΡΗ…‘οΙή≥ΐ»Ξ
ΔΎΉΑ÷ΟI÷–≥δ¬ζΜΤ¬Χ…ΪΤχΧεΚσΘ§‘ΌΦ”»» Δ”–A¬ΝΖέΒΡ”≤÷ ≤ΘΝßΙή
ΔέΉΑ÷ΟII « ’Φ·ΉΑ÷ΟΘ§”Ο”Ύ ’Φ·¬»Μ·¬Ν
ΔήΉΑ÷ΟIIIΩ… ΔΖ≈Φν ·Μ““≤Ω… ΔΖ≈ΈόΥ°¬»Μ·ΗΤΘ§Εΰ’ΏΒΡΉς”ΟœύΆ§
Δίa¥Π Ι”ΟΫœ¥÷ΒΡΒΦΤχΙή Β―ι ±ΗϋΑ≤»Ϊ
A. ΔΌΔΎ B. ΔΎΔέΔί C. ΔΌΔή D. ΔέΔήΔί
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎΜ·―ßΩΈ…œΈß»Τ≈®ΝρΥαΒΡΜ·―ß–‘÷ Ϋχ––»γœ¬ Β―ιΧΫΨΩΘ§ΫΪ ΝΩΒΡ’αΧ«Ζ≈»κ…’±≠÷–Θ§Φ”ΦΗΒΈΥ°Θ§ΫΝΑηΨυ‘»Θ§»ΜΚσΦ”»κ≈®ΝρΥαΘ§…ζ≥…ΚΎ…ΪΈο÷ ΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©…ζ≥…ΒΡ’β÷÷ΚΎ…ΪΈο÷ Θ®ΒΞ÷ Θ© «Θ®ΧνΜ·―ß ΫΘ©________ΓΘ
Θ®2Θ©’β÷÷ΚΎ…ΪΈο÷ ΦΧ–χ”κ≈®ΝρΥαΉς”ΟΜα≤ζ…ζΝΫ÷÷ΤχΧεΘ§Τδ÷–“Μ÷÷ΤχΧε”–¥ΧΦΛ–‘ΤχΈΕΘ§ «¥σΤχΒΡΈέ»ΨΈο÷°“ΜΘ§’β÷÷¥ΧΦΛ–‘ΤχΈΕΤχΧεΈΣΘ®ΧνΜ·―ß ΫΘ©___Θ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________ΓΘ
Θ®3Θ©ΗυΨί’αΧ«”κ≈®ΝρΥαΖ¥”ΠΒΡ Β―ιœ÷œσΘ§ΥΒΟς≈®ΝρΥαΨΏ”–Θ®ΧνΉ÷ΡΗΘ© _______ΓΘ
A Υα–‘ B ΈϋΥ°–‘ C Ά―Υ°–‘ D «Ω―θΜ·–‘
Θ®4Θ©ΫΪΘ®2Θ©÷–≤ζ…ζΒΡ”–¥ΧΦΛ–‘ΤχΈΕΒΡΤχΧεΆ®»κΤΖΚλ»ή“Κ÷–Θ§ΧΫΨΩSO2”κΤΖΚλΉς”ΟΒΡΩ…Ρφ–‘Θ§«κ–¥≥ω Β―ι≤ΌΉςΦΑœ÷œσ______ΓΘΘΜΫΪΘ®2Θ©÷–≤ζ…ζΒΡ”–¥ΧΦΛ–‘ΤχΈΕΒΡΤχΧεΆ®»κ¬»Υ°÷–Θ§ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______ΓΘ
Θ®5Θ©ΙΛ≥ßΟΚ»Φ…’≤ζ…ζΒΡ―ΧΤχ»τ÷±Ϋ”≈≈Ζ≈ΒΫΩ’Τχ÷–Θ§“ΐΖΔΒΡ÷ς“ΣΜΖΨ≥Έ Χβ”–_____ΓΘ
A Έ¬ “–ß”Π B Υα”ξ C Ζέ≥ΨΈέ»Ψ D Υ°ΧεΗΜ”Σ―χΜ·
ΙΛ“Β…œΈΣ Βœ÷»ΦΟΚΆ―ΝρΘ§≥ΘΆ®Ιΐλ―…’ ·Μ“ ·ΒΟΒΫ…ζ ·Μ“Θ§“‘…ζ ·Μ“ΈΣΆ―ΝρΦΝΘ§”κ―ΧΤχ÷–SO2Ζ¥”Π¥”ΕχΫΪΝρΙΧΕ®Θ§Τδ≤ζΈοΩ…ΉςΫ®÷ΰ≤ΡΝœΓΘ–¥≥ωΤδ÷–ΫΪΝρΙΧΕ®ΒΡΜ·―ßΖΫ≥Χ Ϋ «______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”Ο98%ΒΡ≈®ΝρΥαΘ®Π―=1.84g/cm3Θ©≈δ÷Τ0.5mol/LΒΡœΓΝρΥα480mLΓΘ
Θ®1Θ©―Γ”ΟΒΡ÷ς“Σ≤ΘΝß“«Τς≥ΐΝΩΆ≤ΚΆ≤ΘΝßΑτΆβΜΙ–η“Σ”–ΘΚ
ΔΌ___ΔΎ___Δέ___ΓΘ
Θ®2Θ©Φρ“ΣΜΊ¥πœ¬Ν–Έ Χβ
ΔΌΥυ–η≈®ΝρΥαΒΡΧεΜΐΈΣ___mLΘΜ
ΔΎ»γΙϊ Β―ι “”–10mLΓΔ20mLΓΔ50mLΒΡΝΩΆ≤”Π―Γ”Ο___mLΒΡΝΩΆ≤ΉνΚΟΘ§ΝΩ»Γ ±ΖΔœ÷ΝΩΆ≤≤ΜΗ…ΨΜΘ§”ΟΥ°œ¥ΨΜΚσ÷±Ϋ”ΝΩ»ΓΘ§ΫΪ Ι≈®Ε»___Θ®ΧνΓΑΤΪΗΏΓ±ΓΔΓΑΤΪΒΆΓ±ΜρΓΑΈό”ΑœλΓ±Θ§œ¬Ά§Θ©ΓΘ
Δέ‘ΎΉΣ»κ»ίΝΩΤΩ«ΑΘ§…’±≠÷–“ΚΧε”Π___Θ§Ζώ‘ρΜα Ι≈®Ε»___ΓΘ
ΔήΕ®»ί ±±Ί–κ Ι»ή“ΚΑΦ“ΚΟφ”κΩΧΕ»œΏœύΤΫΘ§»τΗ© ”Μα Ι≈®Ε»___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com