
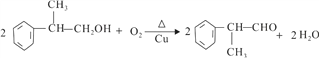
【题目】工业上按下列路线合成结构简式为的物质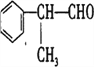 ,该物质是一种香料。
,该物质是一种香料。
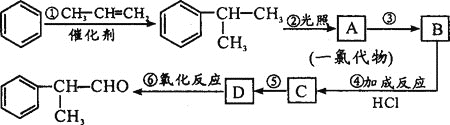
请根据上述路线,回答下列问题:
(1)A的结构简式可能为:____________;
(2)反应①、③、⑤的反应类型分别为_________、_________、__________;
(3)写出下列反应④的化学方程式为(要求:有机物写结构简式,并注明反应条件):
④_______________;⑥_______________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化D的方法,其原因是___________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:
①该物质的水溶液遇FeCl3溶液呈紫色;
②分子中有苯环,且苯环上的一溴代物有两种。
写出符号上述条件的物质可能的结构简式(只写两种):___________、____________。
【答案】 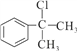 (或
(或 ![]() ) 加成 消去 水解或取代
) 加成 消去 水解或取代 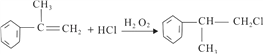
 的水解产物
的水解产物 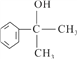 不能通过氧化反应而得到产品(或A中的水解产物
不能通过氧化反应而得到产品(或A中的水解产物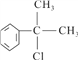 中的-OH不在链端,不能氧化成-CHO)
中的-OH不在链端,不能氧化成-CHO) ![]()
![]()
![]()
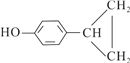
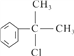
【解析】本题考查有机物的合成和推断,(1)反应②的条件是光照,发生取代反应,氯原子取代取代基上的氢原子,因此A可能结构简式为:![]() 或
或 ;(2)对比反应①前后反应物和生成物结构简式,应该是丙烯中碳碳双键中一个键发生断裂,因此反应①是加成反应,反应④发生加成反应,则B中含有碳碳双键,即反应③发生消去反应,反应⑥发生氧化反应,说明D中含有羟基,即反应⑤应是发生卤代烃的水解,即取代反应或水解反应;(3)反应④发生加成反应,Cl加成到含氢原子多的不饱和碳原子上,即反应方程式为:
;(2)对比反应①前后反应物和生成物结构简式,应该是丙烯中碳碳双键中一个键发生断裂,因此反应①是加成反应,反应④发生加成反应,则B中含有碳碳双键,即反应③发生消去反应,反应⑥发生氧化反应,说明D中含有羟基,即反应⑤应是发生卤代烃的水解,即取代反应或水解反应;(3)反应④发生加成反应,Cl加成到含氢原子多的不饱和碳原子上,即反应方程式为: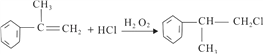 ;反应⑥发生醇的氧化反应,即反应方程式为:
;反应⑥发生醇的氧化反应,即反应方程式为: ;(4)
;(4) 的水解产物
的水解产物  不能通过氧化反应而得到产品(或A中的水解产物
不能通过氧化反应而得到产品(或A中的水解产物 中的-OH不在链端,不能氧化成-CHO;(5)①该物质的水溶液遇FeCl3溶液呈紫色,说明含有酚羟基,即结构简式中含有碳碳双键或除苯环以外还有一个环,②苯环上的一溴代物有2种,说明苯环上有两个取代基,且处于对位,因此同分异构体为
中的-OH不在链端,不能氧化成-CHO;(5)①该物质的水溶液遇FeCl3溶液呈紫色,说明含有酚羟基,即结构简式中含有碳碳双键或除苯环以外还有一个环,②苯环上的一溴代物有2种,说明苯环上有两个取代基,且处于对位,因此同分异构体为![]() 、
、![]() 、
、
![]() 、
、  。
。


科目:高中化学 来源: 题型:
【题目】(1)在下列各组物质中,找出合适的序号填在对应的空格内(每个小题只有一个正确答案):
A.金刚石和石墨 B.12C和14C C.![]() K和
K和![]() Ca
Ca
D.CH3-CH2-CH2-CH3和![]() E.冰醋酸和乙酸
E.冰醋酸和乙酸
F.甲烷和庚烷 G.淀粉和纤维素
①互为同位素的是________。
②互为同素异形体的是__________。
③互为同系物的是________。
④互为同分异构体的是________。
⑤为同一种物质的是________。
(2)现有四种试剂:A.新制的Cu(OH)2;B.浓硝酸;C.AgNO3溶液;D.碘水。为了鉴别下列四瓶无色溶液,请你选择合适的试剂,将其序号填入相应的括号中。
①葡萄糖溶液(______) ②食盐溶液(_________)
③淀粉溶液(_______) ④鸡蛋清溶液(_______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的气体A和B充入2L的密闭容器中,发生反应A(g)+3B(g)2C(g),有关变化如图所示.下列说法正确的是( )
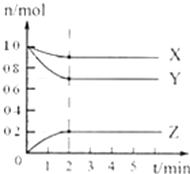
A. 图中表示气体B物质的量随时间变化的曲线是X
B. 2min内用C表示的反应速率υ(C)是0.1molL﹣1min﹣1
C. 平衡时,气体A的浓度是0.45 molL﹣1
D. 平衡时,气体B的转化率是70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标1】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( ) 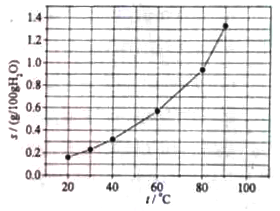
A.溴酸银的溶解时放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是 ( )
A. N、P、As的电负性随原子序数的增大而增大
B. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C. 2p和3p轨道形状均为哑铃形,能量也相等
D. 氮原子的最外层电子的轨道表示式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. SO2和O3、PO43—和ClO4—互为等电子体
B. 甲烷分子失去一个H+,形成CH3—,其碳原子的杂化类型发生了改变
C. CH4、BCl3、SO2都是含有极性键的非极性分子
D. 所有元素的基态原子核外电子排布都遵循构造原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016江苏卷】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
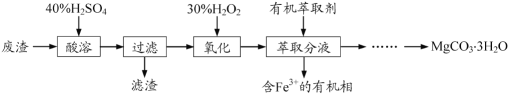
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用下图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
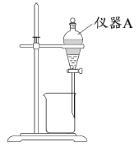
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品。
(2)将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要____________________。
(3)取10.00mL待测液,用___________________ 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视____________,至出现______________的现象时即到达滴定终点。
(5)根据下列数据,计算待测烧碱的纯度:__________________。(保留四位有效数字)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(6)以下操作会造成测量结果偏高的是(_________)
①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com