
【题目】W、X、Y和Z都是周期表中短周期元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,W、Y能组成两种离子化合物;
②Y和X属同周期元素,它们能形成两种常见的化合物;
③X和Z不在同一周期,它们能形成许多种化合物;
④W和X、Y、Z四种元素能形成一种水溶液显碱性的化合物;
(1)W元素是 ;
(2)Y和Z形成的两种常见化合物的分子式是 和 。
(3)写出W、X、Y、Z四种元素形成的化合物与盐酸反应的离子方程式
。
(4)写出X和Z形成的一种六元环状的具有芳香气味的液态化合物跟液溴在溴化铁作用下反应的化学方程式: 。
【答案】(1)Na(2)H2O;H2O2(3)HCO3-+ H+= CO2↑ + H2O(4)![]()
【解析】试题分析:①W的阳离子和Y的阴离子具有相同的核外电子排布,W、Y能组成两种离子化合物,则W为钠元素和Y为氧元素,形成氧化钠和过氧化钠;②Y和X属同周期元素,它们能形成两种常见的化合物,X为碳元素;③X和Z不在同一周期,它们能形成许多种化合物;则Z为氢元素;④W和X、Y、Z四种元素能形成一种水溶液显碱性的化合物,为碳酸氢钠;(1)由以上分析可知,W为Na元素。(2)氢和氧形成的为H2O和H2O2(3)碳酸氢钠和盐酸反应生成氯化钠水和二氧化碳,离子方程式为:HCO3-+ H+= CO2↑ + H2O。(4)碳和氢形成的六元环的化合物为苯,和溴反应生成溴苯和溴化氢,方程式为:
![]()


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机物A(C4H8O2)在稀硫酸加热条件下生成B和C,B可催化氧化为D,D可继续催化氧化为C。推断有机物,按要求写出下列反应方程式(请注明反应条件)
(1)A与氢氧化钠溶液的反应
(2)B催化氧化为D的反应
(3)B在浓硫酸170℃加热条件下的反应
(4)D与银氨溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为:_______________________________________。
②已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)=2CO(g)ΔH=________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g)ΔH=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是( )
A.0.1mol.L-1.min-1
B.0.2mol.L-1.min-1
C.0.3mol.L-1.min-1
D.0.6mol.L-1.min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验I 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。
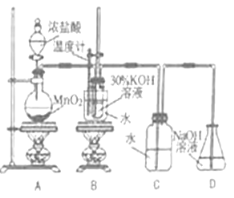
(1)盛放浓盐酸的实验仪器名称是 。
(2)A中发生反应的化学方程式是 。
(3)B中生成氯酸钾的离子反应方程式是 。
(4)若对调B和C装置的位置, (填“能”或“不能”)提高B中氯酸钾的产率,原因是 。
实验II 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定。
乙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样。
a.量取试样20.00ml,用0.10mol·L―1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00ml,则该次滴定所测的试样中盐酸浓度为 ;
b.重复滴定三次后获得实验结果。
②进行乙方案实验:装置如下图所示(夹持器具已略去)。
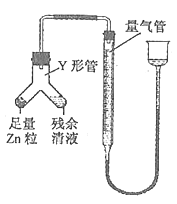
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中,否则会造成实验结果偏低。
(ii)反应完毕,读取H2的体积,读数时应注意:A.冷却至室温b. C.视线与凹液面最低处相切。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将224L的HCl气体溶于815mL水中 (ρ=1.00g/cm 3), 所得盐酸的密度是1.18g/cm 3。
(1)取该盐酸10.0mL,稀释至250.0mL,所得稀盐酸的物质的量浓度?
(2)若将原盐酸溶液与430mL密度为1.14g/cm3质量分数为20%的硫酸混合,(忽略混合时溶液体积变化),求混合后溶液中H+ 物质的量浓度?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图给定的仪器组成一套实验装置(各仪器只允许用一次),在室温、 1.01×105 Pa的条件下测定镁的相对原子质量。
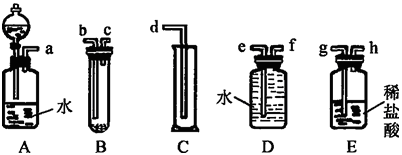
请回答下列问题:
(1)假设气流方向为左→右,则各仪器的接口连接的先后顺序为 (用小写字母填写)。
(2)连接好仪器后,要进行的操作有以下几步:
①待仪器B中的物质恢复至室温时,测量量筒 C中水的体积(假定将测定的体积换算成标准状况下为 V mL);
②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m g,并将其放入试管B中);
③检查各装置的气密性;
④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。
(3)根据实验数据可计算出镁的相对原子质量,其数学表达式为 。
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(5)若未擦净镁条表面的氧化膜就进行实验,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(6)实验中需要用480 mL 1 mol/L的盐酸,配制过程中用于定容的玻璃仪器的规格和名称是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com