
【题目】下列叙述正确的是( )
A. 同温同压下,相同体积的物质,它们的物质的量必相同
B. 常温常压下,等质量的N2与CO所含分子数相同
C. VLO2的质量一定比VLCO2的质量小
D. A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )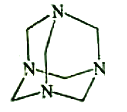
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能与溴水发生反应的是①苯 ②苯酚③亚硫酸④NaOH溶液⑤AgNO3溶液⑥裂化汽油⑦己烷⑧镁粉( )
A. ①③⑦ B. ①④⑧ C. ①⑦ D. ②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH![]() 数目增多 ④c(OH-)增大 ⑤导电性增强⑥
数目增多 ④c(OH-)增大 ⑤导电性增强⑥![]() 增大
增大
A. ①②③ B. ①③⑤ C. ①③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。

当V1=160mL时,则金属粉末中n(Mg)=________ mol,V2=_____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) _____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【六安市第一中学2017届6月适应性考试】下列关于有机化合物的说法正确的是
A.—个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
B.裂化汽油可用于萃取溴水中的溴
C.除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
D.除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苯的同系物中加入少量KMnO4酸性溶液,振荡后褪色,正确的解释为( )
A.苯的同系物分子中的碳原子数比苯分子中的碳原子数多
B.苯环受侧链影响易被氧化
C.侧链受苯环影响易被氧化
D.由于苯环和侧链的相互影响均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【双流中学2017届下学期第二次适应性考试】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A.HClO2的电离平衡常数的数值Ka=10-8
B.pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为合成氨的原料。完成下列填空:
![]()
(1)半水煤气含有少量硫化氢。将半水煤气样品通入_____________________溶液中(填写试剂名称),出现_______________,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式_____________________;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中:V(H2): V(N2)=___。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠溶液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0 mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c molL-1的标准盐酸溶液Vl mL,此时再向溶液中滴入1-2滴_____做指示剂,达到滴定终点时又用去V2 mL标准盐酸溶液。
第二次滴定达到终点时的现象是_______________________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则_______________(填化学式)浓度偏大。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com