
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |
 ,故答案为:
,故答案为: ;
;

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
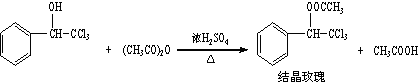
| 三氯甲基苯基甲醇 | 式量:224.5.无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 式量:267.5.白色至微黄色晶体.熔点:88℃.不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g. |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
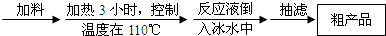
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在中,按粗产品、溶剂的质量比为1: | 得到无色溶液 | |
| ② | 将步骤1所得溶液 | ||
| ③ | 干燥步骤2所得白色晶体, | 白色晶体是结晶玫瑰 |
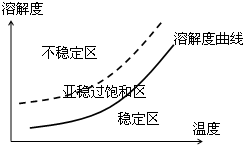
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(OH)?c(C1O2-) |
| c(HC1O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应 | B、分解反应 |
| C、置换反应 | D、复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Ca2+、Na+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、SO42-、NH3?H2O、Cl- |
| B、K+、NO3-、H+、Fe2+ |
| C、K+、Fe3+、H2SO3、Br- |
| D、Na+、OH-、Cl-、AlO2-或([Al(OH)4-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、弱电解质的电离平衡常数受温度影响,与溶液浓度无关 |
| B、电离平衡常数表达了弱电解质的电离能力 |
| C、多元弱酸水溶液中的H+主要是第一步电离产生的 |
| D、由于Ka[HF]>Ka[CH3COOH]>Ka[HCN],所以酸性顺序HF<CH3COOH<HCN |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com