
��ҵ���Ʊ�BaCl2�Ĺ�������ͼ���£�
ij�о�С����ʵ�������ؾ�ʯ����Ҫ�ɷ�BaSO4���Թ�ҵ���̽���ģ��ʵ�顣�����BaSO4(s) + 4C(s) 4CO(g) + BaS(s) ��H1���� 571.2 kJ��mol-1 ��
4CO(g) + BaS(s) ��H1���� 571.2 kJ��mol-1 ��
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) ��H2���� 226.2 kJ��mol-1 ��
2CO2(g) + BaS(s) ��H2���� 226.2 kJ��mol-1 ��
(1)�����ù���NaOH��Һ���յõ����ơ�һ��Ũ�ȵ�������Һ����������ͷų�ζ����Ϊ����������ж���һ����Ľ�������Ϊ��������� ������ţ�
A��������ˮ��Һ��ˮ��������NaOH��H2S����
B��������Һ�����տ����е�����������������NaOH��ͬʱ�����г�ζ������
C��������Һˮ��Ĺ����������տ����е�CO2���ų�H2S����
(2)��ͬ���ʵ���Ũ��BaCl2��KBr�����Һ����μ���AgNO3��Һ�������� ��������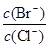 �� ʱ����ʼ���ɵڶ��ֳ���������AgNO3��Һ�Ľ�һ���μӣ���ʱ���ɵij����� Ϊ������
�� ʱ����ʼ���ɵڶ��ֳ���������AgNO3��Һ�Ľ�һ���μӣ���ʱ���ɵij����� Ϊ������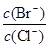 �� ������С��ʼ�ղ��䣩��[��֪Ksp(AgBr)��5.4��10-13��Ksp(AgCl)��2.0��10-10]
�� ������С��ʼ�ղ��䣩��[��֪Ksp(AgBr)��5.4��10-13��Ksp(AgCl)��2.0��10-10]
(3)��ӦC(s) + CO2(g) 2CO(g)�ġ�H�� kJ��mol-1��
2CO(g)�ġ�H�� kJ��mol-1��
(4)ʵ�������б�����������̿��ͬʱ��Ҫͨ���������Ŀ���� ��
��1��C��2�֣���2��AgBr 2.7��10-3 AgCl ʼ�ղ��䣨��1�֣���3��+172.5 ��2�֣�
��4��ʹ���ᱵ��ֱ���ԭ����������IJ������� �٢�Ϊ���ȷ�Ӧ��̿��������Ӧά�ַ�Ӧ������¡���2�֣���(��10��)
���������������1��A�����������ӵ�ˮ��̶�һ���Ǻ����ģ����������ˮ��Һ��ˮ�����ɵ�H2S���岻���������A����ȷ��B�������Ӽ��黹ԭ�ԣ����������Һ���տ����е�����������������NaOH��ͬʱ���ɵ���S���ò���H2S���壬B����ȷ��C��������Һˮ��Ĺ����������տ����е�CO2���ų�H2S���壬�Ӷ��ͷų���ζ�����壬C��ȷ����ѡC��
��2�������廯�����ܶȻ�����С���Ȼ������ܶȻ������������ͬ���ʵ���Ũ��BaCl2��KBr�����Һ����μ���AgNO3��Һ���������廯���������������Ȼ�������ʱ����Һ��һ��ͬʱ����c(Ag��)��c(Cl��)��Ksp(AgCl)��2.0��10-10��c(Ag��)��c(Br��)��Ksp(AgBr)��5.4��10-13��������Һ��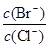 ��
��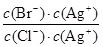 ��
��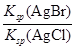 ��2.7��10-3������AgNO3��Һ�Ľ�һ���μӣ���ʱ���ɵij������Ȼ�������Ϊ����������Һ�¶Ȳ��䣬�ܶȻ��������䣬����
��2.7��10-3������AgNO3��Һ�Ľ�һ���μӣ���ʱ���ɵij������Ȼ�������Ϊ����������Һ�¶Ȳ��䣬�ܶȻ��������䣬����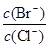 ���䡣
���䡣
��3����֪��ӦBaSO4(s) + 4C(s) 4CO(g) + BaS(s) ��H1���� 571.2 kJ��mol-1 �٣�
4CO(g) + BaS(s) ��H1���� 571.2 kJ��mol-1 �٣�
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) ��H2���� 226.2 kJ��mol-1 �ڣ�����ݸ�˹���ɿ�֪���٣��ڣ���2���õ���ӦC(s) + CO2(g)
2CO2(g) + BaS(s) ��H2���� 226.2 kJ��mol-1 �ڣ�����ݸ�˹���ɿ�֪���٣��ڣ���2���õ���ӦC(s) + CO2(g) 2CO(g)�����Ը÷�Ӧ�ġ�H����(571.2 kJ��mol-1��226.2 kJ��mol-1)��2����172.5kJ��mol-1��
2CO(g)�����Ը÷�Ӧ�ġ�H����(571.2 kJ��mol-1��226.2 kJ��mol-1)��2����172.5kJ��mol-1��
��4��������̼��ʹ���ᱵ��ֱ���ԭ����������IJ�����������٢�Ϊ���ȷ�Ӧ��̿��������Ӧ���ȣ�����ά�ַ�Ӧ������¡�
���㣺�������Ƶ����ʡ��ܶȻ��������㡢��Ӧ�ȵļ����Լ���������Է�Ӧ��Ӱ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)��֪��
��Fe(s)��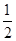 O2(g)=FeO(s)����H����272.0 kJ��mol��1
O2(g)=FeO(s)����H����272.0 kJ��mol��1
��2Al(s)�� O2(g)=Al2O3(s)����H����1675.7 kJ��mol��1
O2(g)=Al2O3(s)����H����1675.7 kJ��mol��1
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��____________________________________
(2)ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B(����ͼ��ʾ)��
�ٸ���ͼ�жϸ÷�Ӧ�ﵽƽ��������������䣬�����¶ȣ���Ӧ���ת����________(�������С�����䡱)��
������B���̱����˷�Ӧ���õ�����Ϊ________(ѡ�����)��
A�������¶ȡ������� B������Ӧ���Ũ�� C�������¶� D��ʹ�ô���
(3)1000 ��ʱ���������������������з�Ӧ��Na2SO4(s)��4H2(g) Na2S(s)��4H2O(g)
Na2S(s)��4H2O(g)
�÷�Ӧ��ƽ�ⳣ������ʽΪ________________________________��
��֪K1000 ��<K1200 ������������ϵ�¶ȣ���������ƽ����Է�����������________(�������С�����䡱)��
(4)�����£����ȡ0.1 mol��L��1 HA��Һ��0.1 mol��L��1 NaOH��Һ��������(��Ϻ���Һ����ı仯���Բ���)����û��Һ��pH��8��
�ٻ��Һ����ˮ�������OH��Ũ����0.1 mol��L��1 NaOH��Һ����ˮ�������OH��Ũ��֮��Ϊ________��
����֪NH4A��ҺΪ���ԣ���֪��HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��pH________7(�<����>������)����ͬ�¶��£������ʵ���Ũ�ȵ�������������Һ��pH�ɴ�С������˳��Ϊ(�����)________��
a��NH4HCO3 b��NH4A c��(NH4)2CO3 d��NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Ϊ�������Դ�����ʣ����ٻ�����Ⱦ���������Ž��ѳ����ȼ�ͼ״�����ɲ�ҵ������ͼ��ʾ��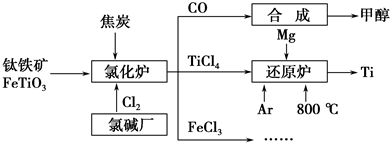
����д���пհף�
(1)����������Ȼ�¯ǰͨ����ȡϴ�ӡ����顢��ɡ�Ԥ�ȵ������������������ԭ���Ͻ��ͷ�������ã�_______________________________________��
��֪�Ȼ�¯�з�Ӧ�����ͽ�̿�������������ʵ�����Ϊ7��6�����Ȼ�¯�еĻ�ԭ����ѧʽ��_________________________________________________��
(2)��֪����Mg(s)��Cl2(g)=MgCl2(s) ��H����641 kJ��mol��1
��2Mg(s)��TiCl4(s)=2MgCl2(s)��Ti(s) ��H����512 kJ��mol��1
��Ti(s)��2Cl2(g)=TiCl4(s)����H��________��
(3)Ar��ͨ�뻹ԭ¯�в������뷴Ӧ��ͨ��Ar����������_________________________________________________________________��
(4)�Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�ء���֪��ȼ�ϵ�ص��ܷ�ӦʽΪ2CH3OH��3O2��4OH��===2CO32����6H2O���õ���������ϵĵ缫��ӦʽΪ____________________________________________��
����һ��ʱ������Һ��pH________(���С�����������䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ǰ����������һ��ȫ�����ӵ����⣬������������峣��������������CO2����Ⱦ������NOx��SOx�ȡ��������Щ����������þͿ��Գ�Ϊ��Ҫ����Դ���Ƚ���˶Ի�������Ⱦ���ֽ���˲�����ԴΣ�����⡣
��1��������̼�ǵ�������ЧӦ��������ף�Ŀǰ���Ǵ���������̼�ķ���֮һ��ʹ����������Ӧ�ϳɼ״����״�������ȼ�ϵ�ص���Ҫȼ�ϡ�CO2��H2��Ӧ�Ʊ�CH3OH��H2O�Ļ�ѧ����ʽΪ ��
��2���ڸ�����һ����̼�ɽ���������ԭΪ��������֪��
��C��s����O2��g��=CO2��g�� ��H1����393��5 kJ��mol��1
��CO2��g����C��s��=2CO��g�� ��H2��+ 172��5 kJ��mol��1
��S��s����O2��g��=SO2��g�� ��H3����296��0 kJ��mol��1
��д��CO��SO2��Ӧ���Ȼ�ѧ����ʽ ��
��3�����᳧���ô���ԭ��������β����CH4�ڴ������¿��Խ�NO2��ԭΪN2��
��֪��CH4��g��+2O2��g��=CO2��g��+2H2O��g�� ��H=-889��6 kJ��mol-1 ��
N2��g��+2O2��g��=2NO2��g�� ��H=+67��7 kJ��mol-1��
��CH4��ԭNO2����ˮ�����͵������Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������֪ʶ����������������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ�� ������Ӧ�Ļ�ѧ��ӦΪ��_____________________________
������Ӧ�Ļ�ѧ��ӦΪ��_____________________________
��2������ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g�� CH3OH��g������H=��90.8 kJ/mol
CH3OH��g������H=��90.8 kJ/mol
��2CH3OH��g�� CH3OCH3��g��+H2O��g������H=��23.5 kJ/mol
CH3OCH3��g��+H2O��g������H=��23.5 kJ/mol
��CO��g��+ H2O��g�� CO2��g��+H2��g������H=��41.3 kJ/mol
CO2��g��+H2��g������H=��41.3 kJ/mol
�ܷ�Ӧ��3H2��g��+3CO��g�� CH3OCH3��g��+CO2��g���Ħ�H="__________" ��
CH3OCH3��g��+CO2��g���Ħ�H="__________" ��
�����ѣ�CH3OCH3��ֱ����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������Ϊ���ԣ��õ�صĸ�����ӦΪ_____________________________��
��3��ú����ͨ��ͨ���о���ͬ�¶���ƽ�ⳣ���Խ������ʵ�����⡣��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��CO��g��+H2O��g�� H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
 2NO2��g�� ��H>0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����___________��
2NO2��g�� ��H>0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ҹ��Ǹ��������,��������Ϊ�����һ,��¯��������Ϊ�ձ������������
I.��֪��Ӧ 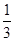 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
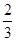 Fe(s)+ CO2(g) ��H��-23.5 kJ��mol-1���÷�Ӧ��
Fe(s)+ CO2(g) ��H��-23.5 kJ��mol-1���÷�Ӧ��
1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1. 0mol,��Ӧ����l0min��ﵽƽ�⡣
��1��CO��ƽ��ת����=____________
��2�������CO��ƽ��ת����,�ٽ�Fe2O3��ת��,�ɲ�ȡ�Ĵ�ʩ��________
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ,ʹ����ƽ���������ֽӴ�
��.��¯���������ķ����е�CO�ɽ��л���,ʹ����һ�������º�H2��Ӧ�Ʊ��״�:
CO(g)+ 2H2(g) CH3OH(g)�������ͼʾ�ش���������:
CH3OH(g)�������ͼʾ�ش���������: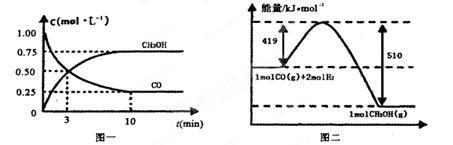
��1���ӷ�Ӧ��ʼ��ƽ��,��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)=________
��2�������¶Ⱥ�������ͬ�������ܱ�������,����ͬ��ʽͶ�뷴Ӧ��,��÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 (Q1��Q2��Q3������0) |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1���п�ѧ�����������FeO���պ�����CO2������Ȼ�ѧ����ʽ���£�6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ��H="-76.0" kJ��molһ1
��������Ӧ��ÿ����1 mol Fe3O4��ת�Ƶ��ӵ����ʵ���Ϊ_______mol��
����֪��C(s)+2H2O(g)=CO2(g)+2H2(g) ��H="+113.4" kJ��molһ1����Ӧ��3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)�ġ�H=__________��
��2����һ�������£�������̼ת��Ϊ����ķ�Ӧ���£�CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g)����һ�ݻ�Ϊ2 L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2 0.2 mol��Lһ1��H2 0.8 mol��Lһ1��CH40.8 mol��Lһ1��H2O1.6 mol��Lһ1����CO2��ƽ��ת����Ϊ________��300 ��ʱ������Ӧ��ƽ�ⳣ��K=____________________��200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8����÷�Ӧ�ġ�H_____(���������<��)O��
C H4 (g)+2 H2O(g)����һ�ݻ�Ϊ2 L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2 0.2 mol��Lһ1��H2 0.8 mol��Lһ1��CH40.8 mol��Lһ1��H2O1.6 mol��Lһ1����CO2��ƽ��ת����Ϊ________��300 ��ʱ������Ӧ��ƽ�ⳣ��K=____________________��200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8����÷�Ӧ�ġ�H_____(���������<��)O��
��3����ʢ�ٴ�ѧ���о���Ա�о���һ�ַ�������ʵ��ˮ������ʱCO2���ŷţ������ԭ����
ͼ��ʾ: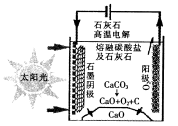
�������������̵�����ת����ʽ��____________________��
��������ⷴӦ���¶�С��900��ʱ���У�̼����ȷֽ�ΪCaO��CO2�������Ϊ����̼���ƣ��������ĵ缫��ӦʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2SO2(g)+O2(g)��2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2(g)����Ϊ1mol SO3(g)�Ħ�H= ��99kJ��mol-1����ش��������⣺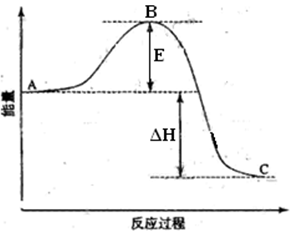
��1��ͼ��A��C�ֱ��ʾ �� ��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ�� ����С����ޡ���Ӱ�졣�÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�� ������ߡ����ǡ����͡�������H (��������С�����䡱)�������� ��
��2��ͼ�С�H�� KJ��mol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪�Ȼ�ѧ����ʽ��
4Al(s) + 3O2(g) �� 2Al2O3 (s)����������H1����3288��6 kJ��mol��1��
4Fe(s) + 3O2 (g) ��2Fe2O3 (s)���� ��H2����1631��8 kJ��mol��1��
���������������������ȷ�Ӧ���Ȼ�ѧ����ʽΪ ��
��2����֪��״����44��8L����ȼ������Һ̬ˮʱ�ų�571��6KJ��������������ȼ����Ϊ ������֪1molҺ̬ˮ�����̬ʱ��Ҫ����44KJ�����������״����22��4L����ȼ��������̬ˮ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com