
����Ŀ������ͼͼ���йص���������ȷ����

A. ��ʾ��mol H2 (g)��ȫȼ������ˮ��������241.8 kJ����
B. ��ʾ���Ȼ�ѧ����ʽΪ��H2(g)+ 1/2 O2(g) = H2O(g) ��H= ��241.8 kJ��mol-1
C. ��ʾ2 mol H2(g)�����е�����һ����2 mol��̬ˮ�����е�������483.6 kJ
D. H2O(g)����������H2(g)��O2(g)������֮��
���𰸡�B
��������
����A��2mol H2 (g)��ȫȼ������ˮ�����Ĺ������ڷ��ȷ�Ӧ���̣�ͼ���ʾ2mol H2 (g)��ȫȼ������ˮ�����ų�241.8 kJ����������B������ͼʾ����Ӧ������������ڲ�������������Ƿ��ȷ�Ӧ������ʽϵ�����룬�ʱ�Ҳ���룬�Ȼ�ѧ����ʽΪ��H2 (g)+1/2O2(g)�TH2O(g) ��H="-241.8" kJ/mol����ȷ��C����ʾ2mol H2 (g)��1mol O2 (g)�����е�������2 mol��̬ˮ�����е�������483.6 kJ������D��H2 (g)��O2 (g)��ȫȼ������ˮ�����Ĺ����Ƿ��ȵģ�1mol H2O(g)����������1mol H2 (g)��0.5mol O2 (g)�������ͣ�����


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ�ã��г���������ȥ��̽��ͭ˿�����Ũ����ķ�Ӧ������ʵ������������ ( )

A. ����ѡ��NaOH��Һ���ն����SO2
B. �����ƶ�����ͭ˿�ɿ���SO2����
C. ����ѡ��Ʒ����Һ��֤SO2������
D. Ϊȷ��CuSO4����,����м�ˮ���۲���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ת���У�A��һ�����Σ�D����Է���������C����Է���������16��E�����X������ǿ�ỹ��ǿ��ʱ���������µ�ת����ϵ��
![]()
��X��ǿ��ʱA��B��C��D��E����ͬһ��Ԫ�أ���X��ǿ��ʱ��A��B��C��D��E��������ͬһ��Ԫ�ء�
��ش�
(1)A��________��Y��________��Z��________��
(2)��X��ǿ��ʱ��E��________��д��B����C�Ļ�ѧ����ʽ��________________________
(3)��X��ǿ��ʱ��E��________��д��B����C�Ļ�ѧ����ʽ��________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У���Ϊ�ȵ��������(����)
A.N2O��CO2B.CO��CO2
C.Na+��F-D.H3O+ ��PCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CO(g)��O2(g)===2CO2(g) ��H����566 kJ��mol��1������˵����ȷ����( )
A��CO��ȼ����Ϊ��283 kJ��mol��1
B��CO��ȼ����Ϊ566 kJ��mol��1
C��CO��ȼ������H����283 kJ��mol��1
D����ͼ�ɱ�ʾ��CO����CO2�ķ�Ӧ���̺�������ϵ
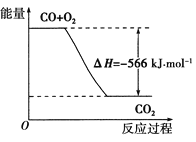
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ����
A��Cu�����Ȼ�����Һ��Cu��Fe3��=Cu2����Fe2��
B��Na2CO3��Һ�м�����CO![]() ��2H��=CO2����H2O
��2H��=CO2����H2O
C��AlCl3��Һ�м������ϡ��ˮ��Al3����4NH3��H2O=AlO![]() ��4NH
��4NH![]() ��2H2O
��2H2O
D��Ba(OH)2��Һ��ϡ��� Ba2++2OH��+2H++SO42��=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺

��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ��������� ��
��2���ձ���������ֽ���������� ��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ (����ƫ��ƫС����Ӱ����)
��4�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� (������ȡ��������)�������к��� (������ȡ��������)����������
��5������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�� ��������ƫ��������ƫС��������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaHCO3���ʵ��й�������ȷ����(����)
A. ֻ����ǿ�ᷴӦ,������ǿ�Ӧ
B. ҽ���Ͽ���������θ�����
C. ���������ᷴӦʱ�ų���CO2�ȵ�������Na2CO3Ҫ��
D. ͬ�¶�ʱ,NaHCO3���ܽ��>Na2CO3���ܽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com