
 能源的开发利用与人类社会的可持续发展息息相关.
能源的开发利用与人类社会的可持续发展息息相关.分析 (1)三个热化学方程式依次编号为①、②、③,根据盖斯定律,(①×2+②×6+③)÷6得,C(s)+O2(g)═CO2(g)△H=$\frac{1}{6}$(2a+6b+c)kJ•mol-1,则C的燃烧热为$\frac{2a+6b+c}{6}$kJ•mol-1;
(2)先求出偏二甲肼的物质的量,再根据物质的量之比等于热量比求出反应热,然后写出热化学方程式;
(3)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(4)以熔融的K2CO3与CO2为反应的环境,负极是失电子发生氧化反应的电极;
(5)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,以此解答.
解答 解:(1)已知:①Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=a kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=b kJ•mol-1
③4Fe(s)+3O2(g)═2Fe2O3(s)△H3=c kJ•mol-1
据盖斯定律,(①×2+②×6+③)÷6得:C(s)+O2(g)═CO2(g)△H=$\frac{1}{6}$(2a+6b+c)kJ•mol-1,则C的燃烧热为$\frac{2a+6b+c}{6}$kJ•mol-1,
故答案为:$\frac{2a+6b+c}{6}$;
(2)1g燃料完全燃烧释放出的能量为42.5kJ,则1mol偏二甲肼完全燃烧释放出的能量为42.5kJ×60=2550kJ,其热化学方程式为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
故答案为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
(3)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2C0(g)+02 (g)═2C02 (g )反应放热,且为氧化还原反应,故可以设计成原电池,故C正确;
D.2H2O(l)═2H2(g)+O2(g)为吸热反应,不能设计呈原电池,故D错误.
故答案为:C;该反应为氧化还原反应且放热反应;
(4)若为一氧化碳燃料电池,在熔融的K2CO3与CO2为反应的环境中,传到离子为碳酸根离子,负极是一氧化碳失电子生成二氧化碳,电极反应为:CO-2e-+CO32-=2CO2 ,故答案为:CO-2e-+CO32-=2CO2 ;
(5)电解时,阳极的电极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3-,电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大;
故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;变大.
点评 本题考查较为综合,涉及反应热与焓变,原电池的设计和燃料电池的电极反应书写,题目难度中等,明确原电池与氧化还原反应的关系及负极发生氧化反应是解答本题的关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂 | |
| B. | 高炉炼铁得到纯度高的铁,加入其他金属炼制得到钢 | |
| C. | 焙制糕点的发酵粉主要成分之一是碳酸氢钠,它也是治疗胃酸过多的一种药剂 | |
| D. | 分子筛常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
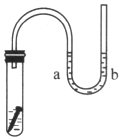 如图所示,试管中放一枚铁钉,并盛放一定量的NaCl溶液,导管中有少量蒸馏水.
如图所示,试管中放一枚铁钉,并盛放一定量的NaCl溶液,导管中有少量蒸馏水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将78gNa2O2与过量CO2反应转移的电子数为2NA | |
| B. | 1mol N2与 4mol H2反应生成的NH3 分子数为2NA | |
| C. | 标准状况下,2.24L SO3中所含原子数为0.4 NA | |
| D. | 标准状况下,18g D2O中所含电子数为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com