
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾和冰的熔化需克服相同类型的作用力 | |
| B. | 氢化物HA的沸点比HB高,是因为1molHA分子中的H-A键断裂时吸收的能量比1molHB分子中键断裂吸收的能量多 | |
| C. | 离子晶体在熔融状态下能导电是因为晶体受热时离子键被削弱,形成了自由移动的离子 | |
| D. | 非金属元素间只能形成共价化合物,金属和非金属元素间形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向小苏打溶液中加入少量石灰水:HCO3-+OH-+Ca2+=CaCO3↓+2H2O | |
| B. | 向烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向HI溶液中加入Fe(OH)3固体:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 向MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42--=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的氧化剂是 ClO- | |
| B. | 消耗 l mol 还原剂,转移电子 3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为 2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源的开发利用与人类社会的可持续发展息息相关.
能源的开发利用与人类社会的可持续发展息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
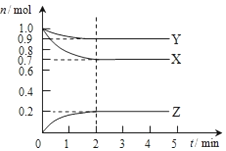 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
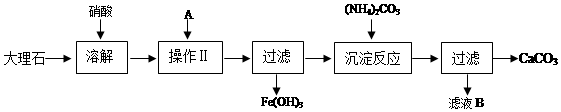
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和 Cl2反应 | B. | 乙烯和 Cl2反应 | ||
| C. | 乙烯和 HCl 反应 | D. | 乙烯和 H2、Cl2 反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com