
| A. | Mg | B. | Cu | C. | Ag | D. | H2 |
科目:高中化学 来源: 题型:选择题
| A. | 运液氯可用钢瓶装,车上应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志 标志 | |
| B. | 冬天严禁在窗门紧闭的室内用煤饼炉取暖,因为生成的CO、SO2等容易引起中毒 | |
| C. | 用铝锅煮菜一般在起锅之前才放盐,既减少加碘盐的损耗,又能增加铝锅的使用寿命 | |
| D. | 严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 在①中加入NH4Cl晶体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 分别在等体积的②、④两溶液加水稀释100倍,所得溶液中水电离出的c(H+)相等 | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
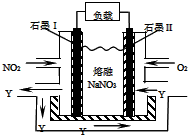 (1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以使甲基橙变红的溶液中:Fe3+、Al3+、Cl-、H2O2 | |
| B. | 由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,Na+、K+、Cl-、HCO3- | |
| C. | 强碱性的溶液中:CO32-、Na+、[Al(OH)4]-、NO3- | |
| D. | 酸性溶液中:Fe3+、Al3+、NO3-、C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
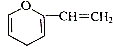
 、
、 、
、 ;
;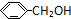 ;
;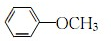 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com