
【题目】在一定条件下的密闭容器中发生反应2X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.3 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,反应达到平衡时各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.3 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,反应达到平衡时各物质的浓度有可能是
A.X2为0.5 mol·L-1B.X2为0.15 mol·L-1
C.Y2为0.2 mol·L-1D.Z为0.4 mol·L-1
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是( )
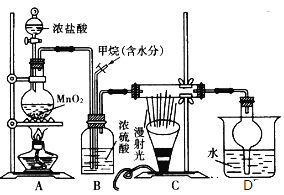
A.实验时先点燃A处酒精灯再通甲烷
B.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C.从D中分离出盐酸的方法为过滤
D.装置C经过一段时间的强光照射后,生成的有机物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含有OH-的溶液一定呈碱性
B.pH为3的盐酸的c(H+)是pH为1的盐酸的100倍
C.Na2SO3溶液与NaHSO3溶液中所含微粒的种类一定相同
D.pH相同的氨水与氢氧化钠溶液,分别与同浓度同体积的盐酸完全中和时,消耗氨水与氢氧化钠溶液的体积一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性介质中,金属铜与氢叠氮酸(NH3)构成的原电池如图所示,电池总反应方程式为2Cu+2C1-+HN3+3H+===2CuC1(s)+N2↑+NH![]() 。下列叙述错误的是
。下列叙述错误的是
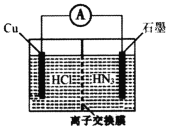
A.离子交换膜为阳离子交换膜
B.若将盐酸换成NaC1,电池的运行效率将会下降
C.负极的电极反应式为Cu—e-+C1-===CuC1(s)
D.当外电路中流过0.1mol电子时,交换膜左侧离子减少0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家有色金属工业“十三五”发展规划要求,再生铅占铅总量比重到2020年升至45%。从废旧铅蓄电池中回收的工艺流程为![]() ,电解原理如图所示。下列说法错误的是
,电解原理如图所示。下列说法错误的是
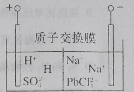
A.电解过程中阳极附近pH明显增大
B.阴极电极反应式为![]() +2e-=Pb+4Cl-
+2e-=Pb+4Cl-
C.电路中通过2 mol电子,阴极可得207 g铅
D.Na2PbCl4浓度下降后,在阴极区加入PbO,可实现电解质溶液的再生使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)+qD(g)的速率和平衡的影响图像如下,下列判断错误的是( )
pC(g)+qD(g)的速率和平衡的影响图像如下,下列判断错误的是( )
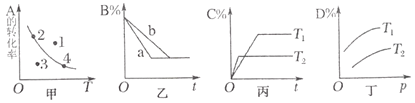
A.甲图中,表示反应速率v正>v逆的是点1
B.乙图中,若m+n=p+q,则a曲线可能使用了催化剂
C.由丙图可知,T1<T2,该反应正反应为放热反应
D.由丁图可知,该反应m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的![]() 可转化为
可转化为![]() ,该反应分两步反应:
,该反应分两步反应:
I:2![]() +(aq)+3O2(g)=2
+(aq)+3O2(g)=2![]() (aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
(aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
II:2![]() (aq)+O2(g)=2
(aq)+O2(g)=2![]() (aq) △H=-146 kJ·mol-1
(aq) △H=-146 kJ·mol-1
则低浓度氨氮废水中的![]() (aq)氧化生成
(aq)氧化生成![]() (aq)的热化学方程式为_____。
(aq)的热化学方程式为_____。
(2)在容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____(填“正反应”或“逆反应”)方向移动,判断理由是____。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是___(填字母)。
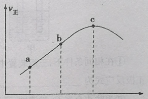
A.逆反应速率:a点小于点c
B.反应在c点达到平衡状态
C.反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(![]() )是复合型的水处理剂,以废铁屑(含有
)是复合型的水处理剂,以废铁屑(含有![]() 、
、![]() 、油污等杂质)为原料制备的流程如下:
、油污等杂质)为原料制备的流程如下:
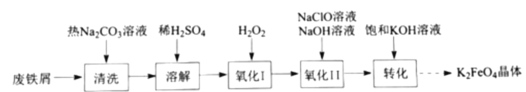
(1)热的![]() 溶液清洗废铁屑的目的是_________。
溶液清洗废铁屑的目的是_________。
(2)氧化Ⅰ中![]() 被氧化成
被氧化成![]() 的离子方程式为________。
的离子方程式为________。
(3)![]() 溶液在不同
溶液在不同![]() 下,
下,![]() 的浓度随时间的变化如图所示。氧化Ⅱ制备
的浓度随时间的变化如图所示。氧化Ⅱ制备![]() 时,选用的加料方式是_________(填字母),原因是________。
时,选用的加料方式是_________(填字母),原因是________。

A. 将![]() 、
、![]() 混合液与氧化Ⅰ所得溶液同时加入到反应容器中
混合液与氧化Ⅰ所得溶液同时加入到反应容器中
B. 将![]() 、
、![]() 混合液缓慢加入到盛有氧化Ⅰ所得溶液的反应容器中
混合液缓慢加入到盛有氧化Ⅰ所得溶液的反应容器中
C. 将氧化Ⅰ所得溶液缓慢加入到盛有![]() 、
、![]() 混合液的反应容器中
混合液的反应容器中
(4)转化步骤中加入饱和![]() 溶液,析出
溶液,析出![]() 晶体的原因是________。
晶体的原因是________。
(5)高铁酸钾是高效复合型的水处理剂的原因:①高铁酸钾有强氧化性,可以用于杀菌消毒;②________。
(6)高铁酸钾可用于高铁电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为![]() ,放电时正极的电极反应式为________。
,放电时正极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拉曼光谱证实,![]() 在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中
在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中![]() 、
、![]() 、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
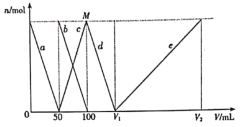
A.![]() 、
、![]() 和[Al(OH)4]-在水溶液中可大量共存
和[Al(OH)4]-在水溶液中可大量共存
B.d线表示的反应为:[Al(OH)4]-+H+=Al(OH)3↓+H2O
C.原固体混合物中![]() 与
与![]() 的物质的量之比为1:1
的物质的量之比为1:1
D.V1=150mL,V2=300mL;M点生成的CO2为0.05mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com