
【题目】酸性介质中,金属铜与氢叠氮酸(NH3)构成的原电池如图所示,电池总反应方程式为2Cu+2C1-+HN3+3H+===2CuC1(s)+N2↑+NH![]() 。下列叙述错误的是
。下列叙述错误的是
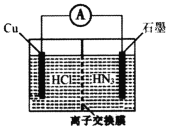
A.离子交换膜为阳离子交换膜
B.若将盐酸换成NaC1,电池的运行效率将会下降
C.负极的电极反应式为Cu—e-+C1-===CuC1(s)
D.当外电路中流过0.1mol电子时,交换膜左侧离子减少0.1mol
【答案】D
【解析】
电池总反应为2Cu+2Cl-+HN3+3H+=2CuCl(s)+N2↑+NH4+,Cu元素的化合价由0价升至+1价,Cu发生氧化反应,原电池中负极发生氧化反应,正极发生还原反应,负极电极反应式为Cu-e-+Cl-=CuCl(s),总反应减去负极电极反应式得正极电极反应式为HN3+2e-+3H+=NH4++N2↑;结合装置图Cu为负极,石墨为正极;原电池工作时,阳离子向正极移动。
A. 根据电极反应式和平衡电荷,离子交换膜将负极室的H+迁移到正极室,离子交换膜为阳离子交换膜,A正确;
B. 若将盐酸换成NaCl,NaCl溶液呈中性,则正极HN3还原成NH3,电池的运行效率会下降,B正确;
C. 负极的电极反应式为Cu—e-+C1-===CuC1(s),C正确;
D. 当电路中流过0.1mol电子时,左侧电极反应式为Cu-e-+Cl-=CuCl(s),该电极反应消耗0.1molCl-,为了平衡电荷,有0.1molH+迁移到右侧,交换膜左侧离子减少0.2mol,D错误;
答案为D。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.46g乙醇中存在的共价键总数为7NA
B.HNO3作为氧化剂得到的电子数一定为3NA
C.1mol甲醇完全燃烧时,转移的电子数为6NA
D.将3.4g H2S全部溶于水,所得溶液中HS-和S2-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2![]() =Mg2++2NH3H2O
=Mg2++2NH3H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:![]() +2CH3COOH=2CH3COO+H2O+CO2↑
+2CH3COOH=2CH3COO+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如图所示。A包含物质为H2O和________(填化学式)。
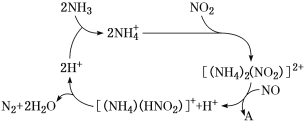
(2)已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH1=-a kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的ΔH=________ kJ·mol-1。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) ΔH>0。
HCN(g)+3H2(g) ΔH>0。
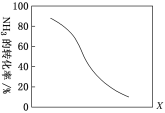
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是________(填字母)。
a.温度 b.压强 c.催化剂 d.![]()
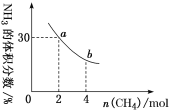
②在一定温度下,向2 L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如下图所示。a点时,CH4的转化率为_______%;平衡常数:K(a)____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g) ![]() MbO2(aq),该反应的平衡常数可表示为K=
MbO2(aq),该反应的平衡常数可表示为K=![]() 。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=
。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=![]() ×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。
×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
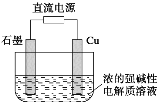
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+![]() O2(g)=H2O(g) △H=Q mol·L-1的反应过程中能量变化如下图,下列说法错误的是
O2(g)=H2O(g) △H=Q mol·L-1的反应过程中能量变化如下图,下列说法错误的是
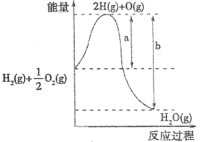
A.Q>0B.a代表该反应的活化能
C.b代表H2O(g)=H2(g)+![]() O2(g)的活化能D.a-b代表该反应的焓变
O2(g)的活化能D.a-b代表该反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中发生反应2X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.3 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,反应达到平衡时各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.3 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,反应达到平衡时各物质的浓度有可能是
A.X2为0.5 mol·L-1B.X2为0.15 mol·L-1
C.Y2为0.2 mol·L-1D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿(主要成分为的Sb2S3,还含有As2S5、PbS、CuO和SiO2等)为原料制备金属锑,其一种工艺流程如下:
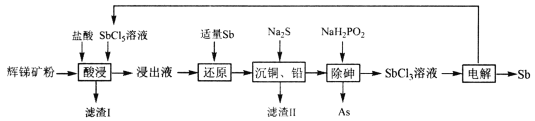
已知:I.浸出液主要含盐酸和SbC13,还含SbC15、CuC12、AsC13和PbC12等杂质。
II.25℃时,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)“酸浸”过程中SbC15和Sb2S3发生反应有一种单质和还原产物SbC13生成,则滤渣I的成分是_______________(填化学式)。
(2)写出“还原”反应的化学方程式_____________________。
(3)已知浸出液中c(Cu2+)=0.0lmol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_____________(填化学式);当CuS、PbS共沉时,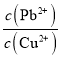 =_________。
=_________。
(4)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为__________________。
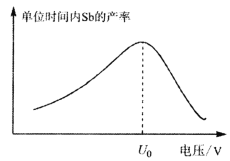
(5)在“电解”过程中,以惰性材料为电极,阳极的电极反应式为___________________,继而发生反应_________________(写出离子方程式)以实现溶液中Sb元素的循环使用。“电解”中单位时间内锑的产率与电压大小关系如图所示。当电压超过U0V时,单位时间内产率降低的原因可能是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒给世界人民的生活和工作带来严重威胁。医用酒精、过氧乙酸![]() 、84消毒液均可有效杀灭新型冠状病毒。下列有关这三种消毒剂的说法正确的是( )
、84消毒液均可有效杀灭新型冠状病毒。下列有关这三种消毒剂的说法正确的是( )
A.酒精浓度越高杀灭病毒效果越好
B.杀灭病毒原理相同
C.过氧乙酸中含有过氧键
D.酒精和84消毒液混合施用效果更好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com