
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿(主要成分为的Sb2S3,还含有As2S5、PbS、CuO和SiO2等)为原料制备金属锑,其一种工艺流程如下:
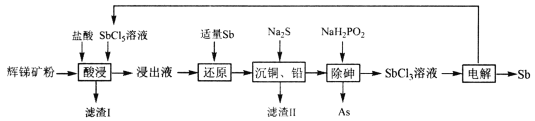
已知:I.浸出液主要含盐酸和SbC13,还含SbC15、CuC12、AsC13和PbC12等杂质。
II.25℃时,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)“酸浸”过程中SbC15和Sb2S3发生反应有一种单质和还原产物SbC13生成,则滤渣I的成分是_______________(填化学式)。
(2)写出“还原”反应的化学方程式_____________________。
(3)已知浸出液中c(Cu2+)=0.0lmol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_____________(填化学式);当CuS、PbS共沉时,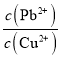 =_________。
=_________。
(4)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为__________________。
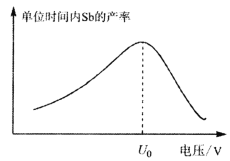
(5)在“电解”过程中,以惰性材料为电极,阳极的电极反应式为___________________,继而发生反应_________________(写出离子方程式)以实现溶液中Sb元素的循环使用。“电解”中单位时间内锑的产率与电压大小关系如图所示。当电压超过U0V时,单位时间内产率降低的原因可能是________________。
【答案】S、SiO2 3SbCl5+2Sb=5SbCl3 CuS 9.0×107 4:3 2Cl--2e-=Cl2![]() Sb3+-2e-=Sb5+ H+参与了电极反应
Sb3+-2e-=Sb5+ H+参与了电极反应
【解析】
由工艺流程可知,辉锑矿粉经盐酸、五氯化锑溶液浸取后,过滤,向浸出液中加入适量的锑粉把过量的五氯化锑还原,然后再加入适量的硫化钠把溶液中的铜离子和铅离子沉淀,过滤,再向滤液中加入NaH2PO2除砷,得到三氯化锑溶液,电解该溶液得到锑和五氯化锑,五氯化锑循环利用。
(1)根据浸出液成分可知,“酸浸”过程中SbC15和Sb2S3反应有S和SbC13生成,则滤渣I的成分是S、SiO2。
(2)“还原”过程中Sb将SbCl5还原为SbCl3,反应的化学方程式3SbCl5+2Sb=5SbCl3。
(3)浸出液中c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1,常温下,Ksp(CuS)=1.0×10-36,铜离子开始沉淀需要的硫离子浓度为1.0![]() 10-34mol/L;Ksp(PbS)=9.0×10-29,铅离子开始沉淀需要的硫离子浓度为9.0
10-34mol/L;Ksp(PbS)=9.0×10-29,铅离子开始沉淀需要的硫离子浓度为9.0![]() 10-28mol/L;故在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是CuS;当CuS、PbS共沉时,
10-28mol/L;故在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是CuS;当CuS、PbS共沉时, 。
。
(4) 在“除砷”过程中,NaH2PO2是还原剂,其氧化产物为H3PO4,P的化合价由+1升高到+5,而As的化合价由+3降到0,根据得失电子守恒,该反应中氧化剂、还原剂的物质的量之比4:3。。
(5) 在“电解”过程中,以惰性材料为电极,阳极发生氧化反应,阳极的电极反应式为2Cl--2e-=Cl2![]() ,继而发生反应Sb3+-2e-=Sb5+;由“电解”中锑的产率与电压大小关系示意图可知,当电压超过U0V时,锑的产率降低,其原因可能是H+参与了电极反应。
,继而发生反应Sb3+-2e-=Sb5+;由“电解”中锑的产率与电压大小关系示意图可知,当电压超过U0V时,锑的产率降低,其原因可能是H+参与了电极反应。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室为探究铜与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( )
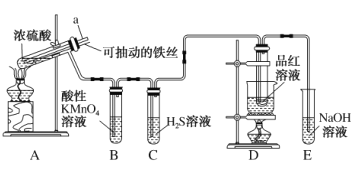
A.装置B、C的目的分别是验证二氧化硫的还原性、氧化性
B.实验结束后可向装置A的溶液中加水,以验证是否有蓝色溶液生成
C.装置D的目的是验证SO2的漂白性及漂白的不稳定性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性介质中,金属铜与氢叠氮酸(NH3)构成的原电池如图所示,电池总反应方程式为2Cu+2C1-+HN3+3H+===2CuC1(s)+N2↑+NH![]() 。下列叙述错误的是
。下列叙述错误的是
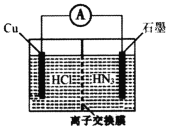
A.离子交换膜为阳离子交换膜
B.若将盐酸换成NaC1,电池的运行效率将会下降
C.负极的电极反应式为Cu—e-+C1-===CuC1(s)
D.当外电路中流过0.1mol电子时,交换膜左侧离子减少0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)+qD(g)的速率和平衡的影响图像如下,下列判断错误的是( )
pC(g)+qD(g)的速率和平衡的影响图像如下,下列判断错误的是( )
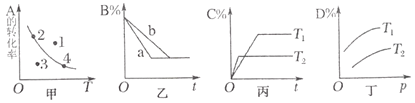
A.甲图中,表示反应速率v正>v逆的是点1
B.乙图中,若m+n=p+q,则a曲线可能使用了催化剂
C.由丙图可知,T1<T2,该反应正反应为放热反应
D.由丁图可知,该反应m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的![]() 可转化为
可转化为![]() ,该反应分两步反应:
,该反应分两步反应:
I:2![]() +(aq)+3O2(g)=2
+(aq)+3O2(g)=2![]() (aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
(aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
II:2![]() (aq)+O2(g)=2
(aq)+O2(g)=2![]() (aq) △H=-146 kJ·mol-1
(aq) △H=-146 kJ·mol-1
则低浓度氨氮废水中的![]() (aq)氧化生成
(aq)氧化生成![]() (aq)的热化学方程式为_____。
(aq)的热化学方程式为_____。
(2)在容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____(填“正反应”或“逆反应”)方向移动,判断理由是____。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是___(填字母)。
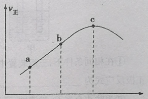
A.逆反应速率:a点小于点c
B.反应在c点达到平衡状态
C.反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应![]() 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的![]()
B.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中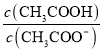 的值减小
的值减小
C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.![]() 溶液中加入少量
溶液中加入少量![]() 固体,
固体,![]() 的水解程度减小,溶液的
的水解程度减小,溶液的![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(![]() )是复合型的水处理剂,以废铁屑(含有
)是复合型的水处理剂,以废铁屑(含有![]() 、
、![]() 、油污等杂质)为原料制备的流程如下:
、油污等杂质)为原料制备的流程如下:
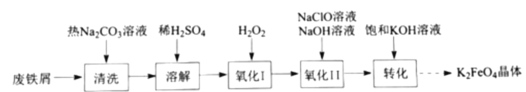
(1)热的![]() 溶液清洗废铁屑的目的是_________。
溶液清洗废铁屑的目的是_________。
(2)氧化Ⅰ中![]() 被氧化成
被氧化成![]() 的离子方程式为________。
的离子方程式为________。
(3)![]() 溶液在不同
溶液在不同![]() 下,
下,![]() 的浓度随时间的变化如图所示。氧化Ⅱ制备
的浓度随时间的变化如图所示。氧化Ⅱ制备![]() 时,选用的加料方式是_________(填字母),原因是________。
时,选用的加料方式是_________(填字母),原因是________。

A. 将![]() 、
、![]() 混合液与氧化Ⅰ所得溶液同时加入到反应容器中
混合液与氧化Ⅰ所得溶液同时加入到反应容器中
B. 将![]() 、
、![]() 混合液缓慢加入到盛有氧化Ⅰ所得溶液的反应容器中
混合液缓慢加入到盛有氧化Ⅰ所得溶液的反应容器中
C. 将氧化Ⅰ所得溶液缓慢加入到盛有![]() 、
、![]() 混合液的反应容器中
混合液的反应容器中
(4)转化步骤中加入饱和![]() 溶液,析出
溶液,析出![]() 晶体的原因是________。
晶体的原因是________。
(5)高铁酸钾是高效复合型的水处理剂的原因:①高铁酸钾有强氧化性,可以用于杀菌消毒;②________。
(6)高铁酸钾可用于高铁电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为![]() ,放电时正极的电极反应式为________。
,放电时正极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含乳酸(HA表示乳酸分子,A-表示乳酸根离子)废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,下列说法正确的是( )
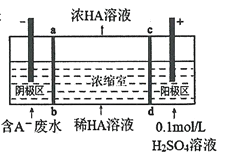
A.阴极区电极反应式为4OH--4e-=2H2O+O2↑
B.交换膜cd为阳离子交换膜,H+从阳极区通过阳离子交换膜进入浓缩室
C.通电一段时间后浓缩室水的量减少,导致乳酸溶液增大
D.当电路中通过1mol电子的电量时,两极一定共产生11.2L(标准状况下)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(Aspirin,乙酰水杨酸)具有解热止痛,抑制血小板凝聚,防止血栓形成的功效,是家庭中常备药品。水杨酸与乙酸酐反应制取阿司匹林的原理如图:
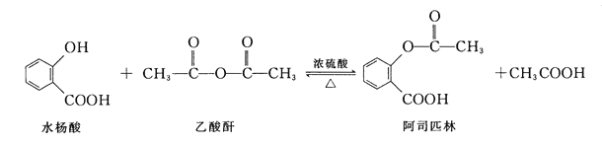
下列有关说法错误的是
A.水杨酸分子中所有原子可能共面
B.水杨酸的同分异构体中,属于苯环上二元取代物的还有5种(不考虑过氧键)
C.乙酰水杨酸在一定条件下能发生加成、水解、酯化等反应
D.分离乙酰水杨酸和乙酸可以加入饱和Na2CO3溶液后分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com