
【题目】下列说法正确的是( )
A.反应![]() 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的![]()
B.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中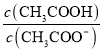 的值减小
的值减小
C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.![]() 溶液中加入少量
溶液中加入少量![]() 固体,
固体,![]() 的水解程度减小,溶液的
的水解程度减小,溶液的![]() 减小
减小
【答案】B
【解析】
A. 反应![]() 在室温下可自发进行,反应的△S<0,反应自发进行的判断依据是△HT△S<0,则该反应的
在室温下可自发进行,反应的△S<0,反应自发进行的判断依据是△HT△S<0,则该反应的![]() ,故A错误;
,故A错误;
B. 醋酸是弱酸,醋酸溶液中存在电离平衡![]() ,加水稀释促进电离,平衡正向移动,但溶液的酸性减弱,c(H+)减小,
,加水稀释促进电离,平衡正向移动,但溶液的酸性减弱,c(H+)减小,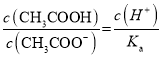 ,温度不变,电离常数不变,故该比值
,温度不变,电离常数不变,故该比值 减小,故B正确;
减小,故B正确;
C. 若在海轮外壳上附着一些铜块,铜块会和铁形成原电池,其中铁作负极,在原电池中,负极失电子被腐蚀,故若附着铜块,海轮外壳的腐蚀速率会加快,故C错误;
D. ![]() 溶液中存在
溶液中存在![]() 的水解平衡
的水解平衡![]() ,加入少量
,加入少量![]() ,其与
,其与![]() 反应生成CaCO3和NaOH,
反应生成CaCO3和NaOH,![]() 的浓度减小,使得
的浓度减小,使得![]() 的水解平衡逆向移动,故
的水解平衡逆向移动,故![]() 的水解程度减小,但溶液的
的水解程度减小,但溶液的![]() 增大,故D错误;
增大,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是
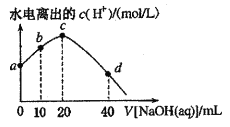
A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+![]() O2(g)=H2O(g) △H=Q mol·L-1的反应过程中能量变化如下图,下列说法错误的是
O2(g)=H2O(g) △H=Q mol·L-1的反应过程中能量变化如下图,下列说法错误的是
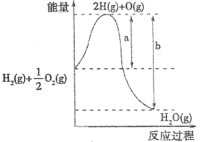
A.Q>0B.a代表该反应的活化能
C.b代表H2O(g)=H2(g)+![]() O2(g)的活化能D.a-b代表该反应的焓变
O2(g)的活化能D.a-b代表该反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,[H+]和[OH-]的关系如图所示:
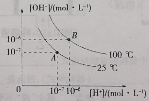
(1)A点水的离子积常数____(填“>”、“=”或“<”)B点水的离子积常数,造成水的离子积常数变化的原因是____。
(2)25℃时,若向水中滴加稀硫酸,___(填“能”或“不能”)使体系处于A点状态,原因是___。
(3)100℃时,若稀硫酸中由水电离产生的[H+]=1×10-8 mol·L-1,则稀硫酸的pH=_____,用pH试纸测定溶液的pH时,正确操作是____。
(4)100℃时将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1:V2=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿(主要成分为的Sb2S3,还含有As2S5、PbS、CuO和SiO2等)为原料制备金属锑,其一种工艺流程如下:
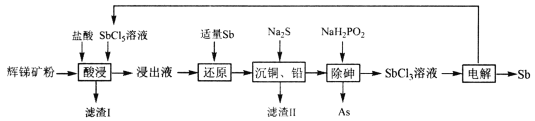
已知:I.浸出液主要含盐酸和SbC13,还含SbC15、CuC12、AsC13和PbC12等杂质。
II.25℃时,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)“酸浸”过程中SbC15和Sb2S3发生反应有一种单质和还原产物SbC13生成,则滤渣I的成分是_______________(填化学式)。
(2)写出“还原”反应的化学方程式_____________________。
(3)已知浸出液中c(Cu2+)=0.0lmol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_____________(填化学式);当CuS、PbS共沉时,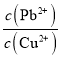 =_________。
=_________。
(4)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为__________________。
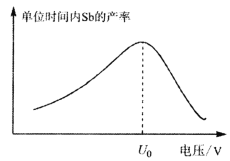
(5)在“电解”过程中,以惰性材料为电极,阳极的电极反应式为___________________,继而发生反应_________________(写出离子方程式)以实现溶液中Sb元素的循环使用。“电解”中单位时间内锑的产率与电压大小关系如图所示。当电压超过U0V时,单位时间内产率降低的原因可能是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2mol/LNH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O)
),c(H2CO3)>c(NH3H2O)
B.0.2mol/L氨水:0.2mol/L>c(OH-)+ c(NH3H2O)
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7:c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.pH=2的盐酸与pH=12的氨水等体积混合:c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )
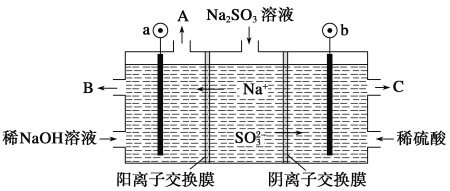
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是甲、乙、丙、丁四种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成丙; ③比例模型为 |
乙 | ①由C、H两种元素组成; ②比例模型为 |
丙 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与丁反应生成相对分子质量为100的酯 |
丁 | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应的生成物的结构简式是__。
(2)乙具有的性质是__(填序号)。
A.无色无味液体,有毒
B.不溶于水,密度比水的大
C.不能使酸性KMnO4溶液褪色
D.任何条件下不与氢气反应
(3)丙的官能团的名称:__;写出丙与Na反应的化学方程式:__。
(4)甲与氢气发生加成反应后生成物质戊,与戊在结构上相似的有机物有一大类(即“同系物”),它们均符合通式CnH2n+2。当n≥__时,这类有机物出现同分异构现象。
(5)丙与丁反应能生成相对分子质量为100的酯,该反应的反应类型为__;其化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者最近研发一种新型铝—石墨烯电池,其负极是金属铝,正极是石墨烯(Cn)薄膜,电解质为阳离子(EMI+)与阴离子(![]() )组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
)组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
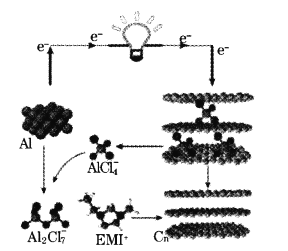
A.该铝电极电池比锂电极电池的能量密度低
B.石墨烯电极的比表面积大,充放电性能优于石墨电极
C.充电时,有机阳离子(EMI+)向铝电极移动
D.放电时,负极的电极反应式为2Al+7Clˉ-6eˉ=Al2Cl![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com