
【题目】若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2mol/LNH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O)
),c(H2CO3)>c(NH3H2O)
B.0.2mol/L氨水:0.2mol/L>c(OH-)+ c(NH3H2O)
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7:c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.pH=2的盐酸与pH=12的氨水等体积混合:c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
【答案】AD
【解析】
A.在0.2mol/LNH4HCO3溶液中发生阴、阳离子的水解反应:![]() +H2O
+H2O![]() NH3·H2O + H+、
NH3·H2O + H+、![]() +H2O
+H2O![]() H2CO3+OH-,由于溶液的pH>7,
H2CO3+OH-,由于溶液的pH>7,![]() 的水解程度小于
的水解程度小于![]() 的水解程度,从而导致溶液中c(
的水解程度,从而导致溶液中c(![]() )减少更多,所以c(
)减少更多,所以c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O),A正确;
),c(H2CO3)>c(NH3H2O),A正确;
B.在0.2mol/L氨水中,存在下列物料守恒:c(![]() )+c(NH3H2O)=0.2mol/L,由于c(OH-)= c(
)+c(NH3H2O)=0.2mol/L,由于c(OH-)= c(![]() )+c(H+),所以c(OH-)+ c(NH3H2O)>0.2mol/L,B不正确;
)+c(H+),所以c(OH-)+ c(NH3H2O)>0.2mol/L,B不正确;
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7,此时溶液中满足电荷守恒,从而得出c(![]() )+c(H+)=c(
)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),由于pH=7,所以c(H+)=c(OH-),c(
)+c(OH-),由于pH=7,所以c(H+)=c(OH-),c(![]() )=c(
)=c(![]() )+2c(
)+2c(![]() ),C不正确;
),C不正确;
D.pH=2的盐酸与pH=12的氨水等体积混合,发生中和反应后,溶液中的溶质为NH4Cl和NH3H2O,此时主要发生如下电离:NH4Cl==![]() +Cl-、NH3·H2O
+Cl-、NH3·H2O![]()
![]() + OH-、H2O
+ OH-、H2O![]() H++OH-,且NH3·H2O的电离程度较小,所以c(
H++OH-,且NH3·H2O的电离程度较小,所以c(![]() )>c(Cl-)>c(OH-)>c(H+),D正确;
)>c(Cl-)>c(OH-)>c(H+),D正确;
故选AD。


科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
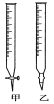
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三大化石燃料燃烧会产生大气污染物,特别是含硫煤燃烧后产生的SO2危害巨大。为了保护环境,科学家提出了下列解决方法,同时还能获得某种重要的工业产品。下列说法错误的是

A.不用O2直接氧化SO2是因为氧化速率太慢
B.图中涉及的反应之一为4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O
C.反应一段时间后,溶液中Fe2(SO4)3的浓度会减小
D.理论上每吸收标况下224mL SO2可以获得0.98gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年“新冠”疫情在全球肆虐。下列说法不正确的是( )
A.酒精可以杀灭病毒是因为其能使构成病毒的蛋白质变性
B.研究表明,病毒可以通过气溶胶传播,气溶胶粒子的直径在![]() 之间
之间
C.口罩的核心材料熔喷布聚丙烯是一种有机高分子化合物
D.“84”消毒液的主要成分是HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应![]() 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的![]()
B.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中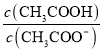 的值减小
的值减小
C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.![]() 溶液中加入少量
溶液中加入少量![]() 固体,
固体,![]() 的水解程度减小,溶液的
的水解程度减小,溶液的![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(![]() )具有强氧化性,
)具有强氧化性,![]() 协同氨法同时脱硫脱硝具有高脱除率。
协同氨法同时脱硫脱硝具有高脱除率。
(1)![]() 单独参与脱硝过程中发生以下反应:
单独参与脱硝过程中发生以下反应:
![]()
![]()
![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ________
________![]()
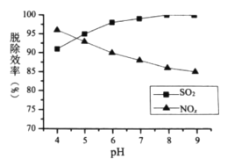
(2)![]() 的浓度、吸收液
的浓度、吸收液![]() 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,
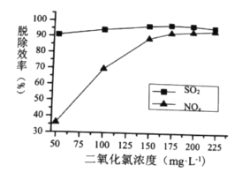
①最适宜的![]() 浓度为________
浓度为________![]() ;
;
②![]() 时,随着
时,随着![]() 的增大,
的增大,![]() 的脱除率下降,其可能的原因是__________
的脱除率下降,其可能的原因是__________
③![]() 时,
时,![]() 会发生歧化反应:
会发生歧化反应:![]() ,当有
,当有![]() 完全反应时,转移电子数目为________
完全反应时,转移电子数目为________![]() ;歧化反应生成的
;歧化反应生成的![]() 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下![]() 将
将![]() 氧化为
氧化为![]() 的离子方程式______________。
的离子方程式______________。
(3)工业上以不锈钢材料为阴极,表面覆盖金属氧化物的石墨为阳极,电解![]() 溶液制备
溶液制备![]() 。写出阳极产生
。写出阳极产生![]() 的电极反应式________;此方法的缺点是所得产品纯度不高,
的电极反应式________;此方法的缺点是所得产品纯度不高,![]() 气体中所含的杂质可能有_____________。
气体中所含的杂质可能有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别为A、B、C、D四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH与A、C、D的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是( )
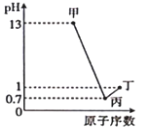
A.简单离子半径: D>C>B>A
B.A、C形成的化合物水溶液呈碱性
C.C、D形成的氢化物稳定性:C>D
D.A、B分别与D形成的化合物均为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素N、S、![]() 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知![]() 的结构为
的结构为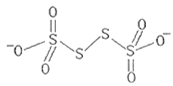 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Kx[Cu(C2O4)y]·zH2O (水合草酸铜(Ⅱ)酸钾)是一种化工原料,实验室制备少量水合草酸铜酸钾并测定样品的组成,实验步骤如下:
I制备CuO
用图1所示装置将溶液混合后,小火加热至蓝色沉淀变黑色生成CuO,煮沸5~10分钟。稍冷却后全部转移至图2装置过滤,并用蒸馏水洗涤沉淀2~3次。
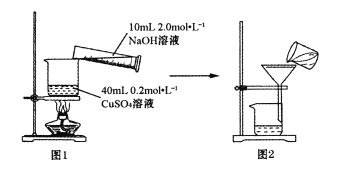
(1)①指出图2装置中操作中的错误___________,图2操作需用蒸馏水洗涤沉淀2~3次,其目为___________。
②检验沉淀洗涤干净的方法为___________。
Ⅱ制备KHC2O4和K2C2O4混合溶液
称取3.0g H2C2O4·2H2O放入250mL烧杯中,加入40mL蒸馏水,微热(温度低于80℃)溶解。稍冷后分数次加入2.2g无水K2CO3,充分反应后生成含KHC2O4和K2C2O4的混合物。
(2)该步骤中所得混合物中n(KHC2O4):n(K2C2O4)=____________。(取整数)
Ⅲ制备水合草酸铜酸钾晶体
将KHC2O4和K2C2O4混合溶液水浴微热,再将CuO连同滤纸一起加入到该溶液中,充分反应至CuO沉淀全部溶解,取出滤纸后,加热浓缩、冷却结晶、过滤,用乙醇淋洗,自然晾干,称量得到样品2.9760g(电子天平称量)。
(3)①步骤Ⅲ中KHC2O4的作用是__________。
②用乙醇淋洗而不用水的优点是__________。
③溶解CuO沉淀时,连同滤纸一起加人到溶液中的目的是__________。
Ⅳ测定水合草酸铜酸钾晶体的成分
取少量制得的样品配成溶液。用标准酸性髙锰酸钾溶液滴定![]() 、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(
、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(![]() )=1:2,假设制备样品的过程中Cu2+无损耗。
)=1:2,假设制备样品的过程中Cu2+无损耗。
(4)水合草酸铜(Ⅱ)酸钾晶体的化学式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com