
����Ŀ������ʯȼ��ȼ�ջ����������Ⱦ��ر��Ǻ���úȼ�պ������SO2Σ����Ϊ�˱�����������ѧ����������н��������ͬʱ���ܻ��ij����Ҫ�Ĺ�ҵ��Ʒ������˵���������

A.����O2ֱ������SO2����Ϊ��������̫��
B.ͼ���漰�ķ�Ӧ֮һΪ4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O
C.��Ӧһ��ʱ�����Һ��Fe2(SO4)3��Ũ�Ȼ��С
D.������ÿ���ձ����224mL SO2���Ի��0.98gH2SO4
���𰸡�C
��������
A��ͼ����ʾʹ����������������Ŀ���Ǽӿ췴Ӧ���ʣ��ʲ���O2ֱ������SO2����Ϊ��������̫����A��ȷ��
B��ͼ����ʾ��FeSO4�����������Ի���������Fe2(SO4)3�÷�ӦΪ��4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O��B��ȷ��
C������ͼ����ʾ��Fe2(SO4)3������ͼ��ѭ����������������Ӧһ��ʱ�����Һ��Fe2(SO4)3��Ũ�Ȼ�䣬C����
D�������ܷ�ӦΪ��![]() ��n(H2SO4)=n(SO2)��������ÿ���ձ����224mL SO2���H2SO4������Ϊ��
��n(H2SO4)=n(SO2)��������ÿ���ձ����224mL SO2���H2SO4������Ϊ��![]() ��D��ȷ��
��D��ȷ��
�ʴ�Ϊ��C��


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л������е�ͬ���칹������ձ飬��֪������Ӵ���һ������(��ӳ)�칹�壺

�������·�Ӧ��
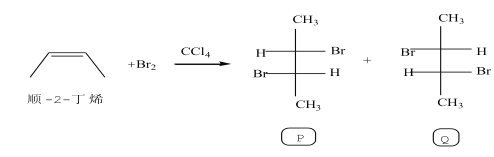
�����жϴ������
A.������Ӧ���ڼӳɷ�Ӧ
B.P��������2�ֹ�����
C.Q��������2������̼ԭ��
D.P��Q��Ϊ�����칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.100 0 mol��L-1NH4Cl��Һ����μ���0.100 0 mol��L-1KOH��Һʱ����Һ��pH��KOH��Һ����Ĺ�ϵ��ͼ��ʾ(�����ǻӷ�)������˵����ȷ����( )
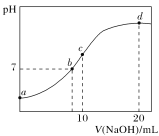
A.��a��ʾ��Һ��ˮ�ĵ���̶�С����ͬ�¶��´�ˮ�ĵ���̶�
B.��b��ʾ��Һ�У�c(NH4+)��c(K��)��c(H��)��c(OH��)
C.��d��ʾ��Һ�е�����Ϊһˮ�ϰ�
D.��c��ʾ��Һ�У�c(K��)��c(H��)��c(NH3��H2O)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʵ���˵����ȷ���ǣ� ��
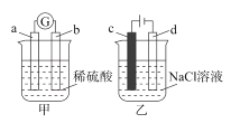
A.������b�缫�ı��������ݲ�������bΪ����
B.������aΪZn��bΪCu��������������SO![]() ����Ũ��������
����Ũ��������
C.������c�缫ΪFe������һ��ʱ�����Һ�����
D.������c��d��Ϊ���Ե缫������22.4LCl2ʱ����ת�Ƶ���2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2(g)+![]() O2(g)=H2O(g) ��H=Q mol��L-1�ķ�Ӧ�����������仯����ͼ������˵���������
O2(g)=H2O(g) ��H=Q mol��L-1�ķ�Ӧ�����������仯����ͼ������˵���������
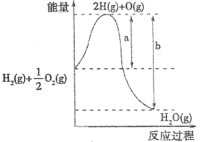
A.Q>0B.a�����÷�Ӧ�Ļ��
C.b����H2O(g)=H2(g)+![]() O2(g)�Ļ��D.a-b�����÷�Ӧ���ʱ�
O2(g)�Ļ��D.a-b�����÷�Ӧ���ʱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йغϳɰ���ҵ���������ܹ����ա�������ԭ�������͵���
A.�������������ߵ�λʱ�䰱�IJ���
B.��ѹ�ȳ�ѹ�����������ںϳɰ��ķ�Ӧ
C.500����±����¸������ںϳɰ��ķ�Ӧ
D.N2��H2�����ʵ���֮��1��2.8��ϣ��������ڰ��ĺϳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ĵ���ƽ���У�[H+]��[OH-]�Ĺ�ϵ��ͼ��ʾ��
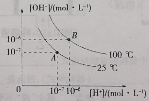
(1)A��ˮ�����ӻ�����____(����>������=������<��)B��ˮ�����ӻ����������ˮ�����ӻ������仯��ԭ����____��
(2)25��ʱ������ˮ�еμ�ϡ���ᣬ___(������������������)ʹ��ϵ����A��״̬��ԭ����___��
(3)100��ʱ����ϡ��������ˮ���������[H+]=1��10-8 mol��L-1����ϡ�����pH=_____����pH��ֽ�ⶨ��Һ��pHʱ����ȷ������____��
(4)100��ʱ��pH=11�Ŀ�������ҺV1 L��pH=1��ϡ����V2 L���(���Ϻ���Һ�����Ϊԭ����Һ�����֮��)�����û����Һ��pH=2����V1��V2=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ������������仯�ɺ��ԣ�����ʱ����ָ����Һ�������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
A.0.2mol/LNH4HCO3��Һ(pH��7)��c(![]() )��c(
)��c(![]() )��c(H2CO3)��c(NH3H2O)
)��c(H2CO3)��c(NH3H2O)
B.0.2mol/L��ˮ��0.2mol/L��c(OH-)+ c(NH3H2O)
C.��0.1mol/LNH4HCO3��Һ��ͨ��CO2����ҺpH=7��c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.pH=2��������pH=12�İ�ˮ�������ϣ�c(![]() )��c(Cl-)��c(OH-)��c(H+)
)��c(Cl-)��c(OH-)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽�����ܴﵽԤ��Ŀ�ĵ���
ʵ�鷽�� | ʵ��Ŀ�� | |
A | ����֧�Թ��зֱ���� | ̽�� |
B | ȡ | ����8%�� |
C | �� | �Ƚ� |
D | ��ͬ��ͬŨ�� | �Ƚ������Ԫ�طǽ�����ǿ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com