
【题目】下列有关合成氨工业的叙述,能够用勒·夏特列原理来解释的是
A.加入催化剂可以提高单位时间氨的产量
B.高压比常压条件更有利于合成氨的反应
C.500℃高温比室温更有利于合成氨的反应
D.N2和H2按物质的量之比1:2.8混合,更有利于氨的合成
【答案】B
【解析】
A.催化剂不能使平衡发生移动,只能改变化学反应速率和缩短达到平衡得时间,故加入催化剂可以提高单位时间氨的产量不能用勒夏特列原理解释,A不符合题意;
B.工业上合成氨的反应为:![]() ,正反应是一个气体体积减小的方向,故高压比常压条件更有利于合成氨的反应能用勒夏特列原理解释,B符合题意;
,正反应是一个气体体积减小的方向,故高压比常压条件更有利于合成氨的反应能用勒夏特列原理解释,B符合题意;
C.合成氨反应正反应是一个放热反应,故应该室温比500℃高温更有利于合成氨的反应,而工业上采用500℃高温是由于催化剂活性和反应速率原因,C不符合题意;
D.N2和H2按物质的量之比1:2.8混合,减小H2的物质的量,平衡向逆向移动,不利于氨的合成,不能用勒夏特列原理解释,减小H2的物质的量主要是采用增大廉价原料N2的用量来提高难得的原料H2的利用率,D不符合题意;
故答案为:B。


科目:高中化学 来源: 题型:
【题目】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。当向其中加入少量酸或碱时,溶液的酸碱性变化不大。回答下列问题:
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为______;另一份加入少量KOH溶液时,发生反应的离子方程式为______。
(2)现将0.04molL-1HA溶液和0.02molL-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)______c(CN-)。(填“<”“=”或“>”);
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是______。
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c(![]() )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______mol/L。
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
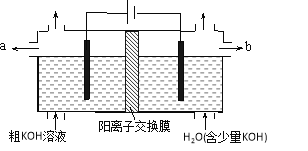
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
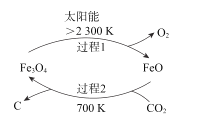
【题目】二氧化碳的回收利用是环保领域研究热点。
(1)在太阳能的作用下,以CO2为原料制炭黑的流程如图所示。总反应的化学方程式为__;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。
CH3OH+H2O。
已知298K和101kPa条件下:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l) ΔH=-akJ/mol;
CH3OH(g)+H2O(l) ΔH=-akJ/mol;
2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;
CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol;
则CH3OH(l)的标准燃烧热ΔH=__;
(3)在催化剂M的作用下,CO2经过催化氢化合成低碳烯烃等。
CO2和H2同时发生下列两个反应:
①2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH<0
CH2=CH2(g)+4H2O(g) ΔH<0
②2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
如图是乙烯在相同时间内,不同温度下的产率,当温度高于460℃时乙烯产率降低的原因不可能是__。
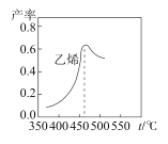
A.催化剂M的活性降低
B.①反应的平衡常数变大
C.生成甲醚的量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三大化石燃料燃烧会产生大气污染物,特别是含硫煤燃烧后产生的SO2危害巨大。为了保护环境,科学家提出了下列解决方法,同时还能获得某种重要的工业产品。下列说法错误的是

A.不用O2直接氧化SO2是因为氧化速率太慢
B.图中涉及的反应之一为4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O
C.反应一段时间后,溶液中Fe2(SO4)3的浓度会减小
D.理论上每吸收标况下224mL SO2可以获得0.98gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,北京航空航天大学教授团队与中科院高能物理研究所合作,合成了Y、Sc(Y1/NC,Sc1/NC)单原子催化剂,用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法错误的是
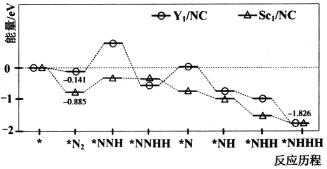
A.相同条件下,两种催化反应的焓变相同
B.实际生产中将催化剂的尺寸处理成纳米级颗粒可提高氨气的平衡转化率
C.使用Sc1/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为*N2+H→*NNH
D.升高温度一定可以提高氨气单位时间内的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年“新冠”疫情在全球肆虐。下列说法不正确的是( )
A.酒精可以杀灭病毒是因为其能使构成病毒的蛋白质变性
B.研究表明,病毒可以通过气溶胶传播,气溶胶粒子的直径在![]() 之间
之间
C.口罩的核心材料熔喷布聚丙烯是一种有机高分子化合物
D.“84”消毒液的主要成分是HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(![]() )具有强氧化性,
)具有强氧化性,![]() 协同氨法同时脱硫脱硝具有高脱除率。
协同氨法同时脱硫脱硝具有高脱除率。
(1)![]() 单独参与脱硝过程中发生以下反应:
单独参与脱硝过程中发生以下反应:
![]()
![]()
![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ________
________![]()
(2)![]() 的浓度、吸收液
的浓度、吸收液![]() 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,
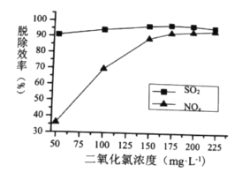
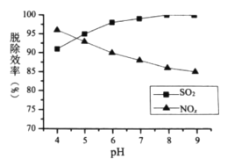
①最适宜的![]() 浓度为________
浓度为________![]() ;
;
②![]() 时,随着
时,随着![]() 的增大,
的增大,![]() 的脱除率下降,其可能的原因是__________
的脱除率下降,其可能的原因是__________
③![]() 时,
时,![]() 会发生歧化反应:
会发生歧化反应:![]() ,当有
,当有![]() 完全反应时,转移电子数目为________
完全反应时,转移电子数目为________![]() ;歧化反应生成的
;歧化反应生成的![]() 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下![]() 将
将![]() 氧化为
氧化为![]() 的离子方程式______________。
的离子方程式______________。
(3)工业上以不锈钢材料为阴极,表面覆盖金属氧化物的石墨为阳极,电解![]() 溶液制备
溶液制备![]() 。写出阳极产生
。写出阳极产生![]() 的电极反应式________;此方法的缺点是所得产品纯度不高,
的电极反应式________;此方法的缺点是所得产品纯度不高,![]() 气体中所含的杂质可能有_____________。
气体中所含的杂质可能有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
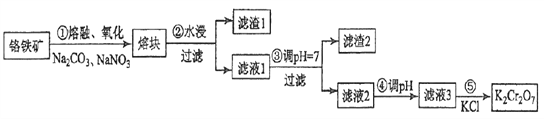
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_________。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_________。
(2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。
(3)步骤④调滤液2的pH使之变______(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
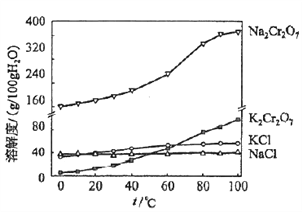
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com