
【题目】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。当向其中加入少量酸或碱时,溶液的酸碱性变化不大。回答下列问题:
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为______;另一份加入少量KOH溶液时,发生反应的离子方程式为______。
(2)现将0.04molL-1HA溶液和0.02molL-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)______c(CN-)。(填“<”“=”或“>”);
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是______。
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c(![]() )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______mol/L。
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______mol/L。
【答案】A-+H+=HA HA+OH-=H2O+A- > c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 2.3×10-3
【解析】
(1)溶液中含有HA和NaA两种溶质,加入少量的盐酸,会发生强酸制弱酸,其离子方程式为H++A-=HA;加入KOH,会与溶液中的酸HA反应,其离子方程式为OH-+HA=H2O+A-;
(2)现将0.04molL-1HA溶液和0.02molL-1NaOH溶液等体积混合,酸碱发生中和反应,酸中和一半,得到了NaA和HA等物质的量浓度的混合溶液,两者浓度均为0.1mol·L-1;
①若HA是HCN,则溶液中的溶质为HCN和NaCN,HCN在溶液中会电离,电离方程式:HCN![]() H++CN-;CN-在溶液中会水解,其水解方程式:CN-+H2O
H++CN-;CN-在溶液中会水解,其水解方程式:CN-+H2O![]() HCN+OH-;HCN电离使得溶液呈酸性,CN-水解使得溶液呈碱性,现溶液呈碱性,说明CN-的水解程度大于HCN的电离程度;则溶液中c(HCN)>c(CN-)。根据物料守恒,2c(Na+)=c(HCN)+c(CN-),结合c(HCN)>c(CN-),可得2c(Na+)>2c(CN-),则c(Na+)>c(CN-);
HCN+OH-;HCN电离使得溶液呈酸性,CN-水解使得溶液呈碱性,现溶液呈碱性,说明CN-的水解程度大于HCN的电离程度;则溶液中c(HCN)>c(CN-)。根据物料守恒,2c(Na+)=c(HCN)+c(CN-),结合c(HCN)>c(CN-),可得2c(Na+)>2c(CN-),则c(Na+)>c(CN-);
②若HA是CH3COOH,则溶液中的溶质为CH3COONa和CH3COOH;CH3COOH在溶液中会电离,电离方程式:CH3COOH![]() CH3COO-+H+;CH3COO-在溶液中会水解,水解方程式为CH3COO-+H2O
CH3COO-+H+;CH3COO-在溶液中会水解,水解方程式为CH3COO-+H2O![]() CH3COOH+OH-;CH3COOH电离使得溶液呈酸性,CH3COO-水解使得溶液呈碱性,现溶液呈酸性,则CH3COOH的电离程度大于CH3COO-的水解程度,电离程度较大,使得溶液中的c(CH3COO-)>c(CH3COOH);根据物料守恒,2c(Na+)=c(CH3COO-)+c(CH3COOH),结合两式,可得c(CH3COO-)>c(Na+),由于弱电解质电离是微弱的,因此c(Na+)>c(H+);溶液呈酸性,则c(H+)>c(OH-),则溶液中的离子浓度大小排序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
CH3COOH+OH-;CH3COOH电离使得溶液呈酸性,CH3COO-水解使得溶液呈碱性,现溶液呈酸性,则CH3COOH的电离程度大于CH3COO-的水解程度,电离程度较大,使得溶液中的c(CH3COO-)>c(CH3COOH);根据物料守恒,2c(Na+)=c(CH3COO-)+c(CH3COOH),结合两式,可得c(CH3COO-)>c(Na+),由于弱电解质电离是微弱的,因此c(Na+)>c(H+);溶液呈酸性,则c(H+)>c(OH-),则溶液中的离子浓度大小排序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(3)缓冲溶液的pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用,H2CO3是酸,HCO3-为共轭碱;实测某人血液的pH=7.2,c(HCO3-)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2,带入数据可得,7.2=6.2+![]() , 求得c(H2CO3)= 2.3×10-3mol·L-1。
, 求得c(H2CO3)= 2.3×10-3mol·L-1。


科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]()
![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
B.苯乙烯能使溴水褪色,是因为两者发生了加成反应
C.乙苯和苯乙烯苯环上的一氯代物均为3种
D.乙苯和苯乙烯分子内共平面的碳原子数最多均为7个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法正确的是( )
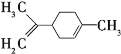
A.分子式为C10H16,其一氯代物有6种
B.分子中所有的碳原子一定在同一平面上
C.和丁基苯(![]() )互为同分异构体
)互为同分异构体
D.一定条件下,可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应中质子(H+)的转移,可以重新定义酸和碱:酸=质子+(共轭)碱。因此酸碱之间存在彼此的共轭关系:HA+BA-+BH+。关于反应:HC2O4-+H3O+![]() H2C2O4+H2O、HC2O4-+OH-
H2C2O4+H2O、HC2O4-+OH-![]() C2O42-+H2O,下列判断正确的是
C2O42-+H2O,下列判断正确的是
A. HC2O4-的共轭碱为H2C2O4
B. HC2O4-的共轭酸为C2O42-
C. HC2O4-既有酸性又有碱性
D.H3O+是水的共轭碱,H2O是OH-的共轭酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机分子中的同分异构现象很普遍,已知乳酸分子存在一对立体(对映)异构体:

对于如下反应:
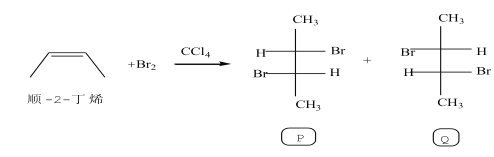
下列判断错误的是
A.上述反应属于加成反应
B.P分子中有2种官能团
C.Q分子中有2个手性碳原子
D.P和Q互为立体异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应: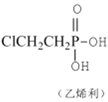 +4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
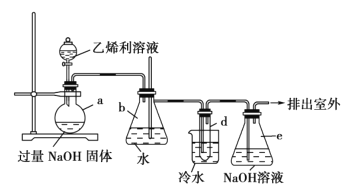
(1)仪器b的名称为______;其中长玻璃导管的作用是______。
(2)e装置的作用是______;其中所发生反应的离子方程式为______。
(3)试管d中发生反应的化学方程式为______。若用冰水代替烧杯中的冷水,可能引起的不安全后果是______。
(4)实验消耗40%乙烯利(摩尔质量为Mg·mol-1)溶液50g,制得产品mg,则乙烯利合成1,2-二溴乙烷的产率为______(用含M、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以进行实验并能达到实验目的的是
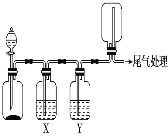
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 用CaO与浓氨水制取并收集纯净干燥的NH3 | NaOH溶液 | 碱石灰 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是_____________。
、ClO-、S2-中结合H+的能力最弱的是_____________。
(2)常温下0.1molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____________(填字母)。
A.c(H+) B.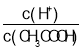 C.
C.![]() D.c(OH-)
D.c(OH-)
(3)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK_____________NaClO,两溶液中:c(Na+)-c(ClO)_____________c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(4)向0.1molL-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液pH=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关合成氨工业的叙述,能够用勒·夏特列原理来解释的是
A.加入催化剂可以提高单位时间氨的产量
B.高压比常压条件更有利于合成氨的反应
C.500℃高温比室温更有利于合成氨的反应
D.N2和H2按物质的量之比1:2.8混合,更有利于氨的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com