
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法正确的是( )
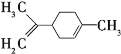
A.分子式为C10H16,其一氯代物有6种
B.分子中所有的碳原子一定在同一平面上
C.和丁基苯(![]() )互为同分异构体
)互为同分异构体
D.一定条件下,可以发生加成、取代、氧化、还原等反应
科目:高中化学 来源: 题型:
【题目】砷化硼![]() 是一种具有超高热导率的新型半导体材料,其制备原理为
是一种具有超高热导率的新型半导体材料,其制备原理为![]() 。下列说法错误的是( )
。下列说法错误的是( )
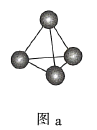

A.图a表示![]() 结构,
结构,![]() 分子中成键电子对与孤电子对的数目之比为3:1
分子中成键电子对与孤电子对的数目之比为3:1
B.图b表示晶态单质硼![]() 的基本结构单元,该基本结构单元为正二十面体
的基本结构单元,该基本结构单元为正二十面体
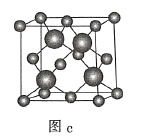
C.图c表示![]() 晶胞结构,
晶胞结构,![]() 原子的配位数为4
原子的配位数为4
D.该反应所涉及的元素中,I的原子半径最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
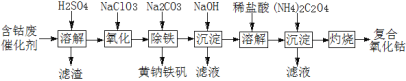
(1)用H2SO4溶解后过滤,得到的滤渣是____(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是____。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 =Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是____。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:____。
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是____。
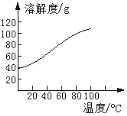
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究表明,咖啡中含有的咖啡酸能使人心脑血管更年轻。咖啡酸的球棍模型如图所示,下列有关咖啡酸的叙述不正确的是( )

A.咖啡酸的分子式为C9H8O4
B.咖啡酸中的含氧官能团只有羧基、酚羟基
C.咖啡酸可以发生氧化反应、消去反应、酯化反应、加聚反应
D.![]() 是咖啡酸的一种同分异构体,1mol该物质最多可消耗3molNaOH
是咖啡酸的一种同分异构体,1mol该物质最多可消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
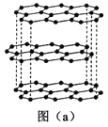
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为_______,原子间存在的共价键类型有________,碳原子的杂化轨道类型为________。
(2)SiCl4分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
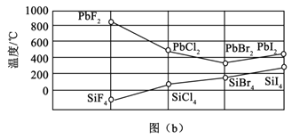
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______。(填“增强”“不变”或“减弱”)
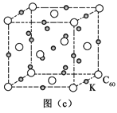
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬(CrN)薄膜具有韧性高、耐磨性好、涂层结合强度高、更好的抗高温氧化性和抗腐蚀性以及内应力低等优点,在汽车工业、航空航天等领域取得了很好的应用效果。某化学兴趣小组利用下列装置进行氮化铬的制备(部分夹持装置已略),回答下列问题:
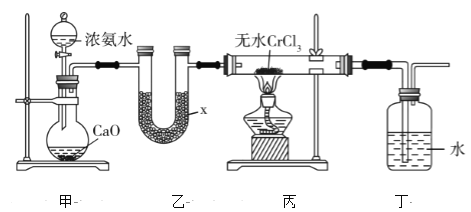
(1)仪器x的名称为________,x中盛有的试剂为干燥剂,该干燥剂可以是________(填字母)。
a.浓硫酸 b.碱石灰 c.CaO d.无水CaCl2
(2)装置甲中CaO可用NaOH固体代替,其原因是_______________________________________________。
(3)若装置丙玻璃管中产生大量白烟,则发生反应的化学方程式为__________________________________。
(4)装置丁洗气瓶中水的作用是________________________________________。该装置是否合适?合适则写出合适的理由,不合适则说明改进措施:_____________________________________________________
(5)实验前,在装置丙中加入15.850g CrCl3,实验结束后,取出装置丙中的固体加热至质量不再减少,称量剩余固体质量为7.525g,则制备的产品纯度为______%(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 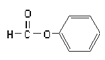 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。当向其中加入少量酸或碱时,溶液的酸碱性变化不大。回答下列问题:
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为______;另一份加入少量KOH溶液时,发生反应的离子方程式为______。
(2)现将0.04molL-1HA溶液和0.02molL-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)______c(CN-)。(填“<”“=”或“>”);
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是______。
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c(![]() )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______mol/L。
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
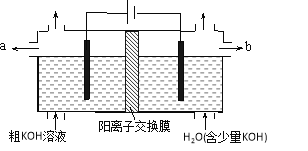
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com