
【题目】ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
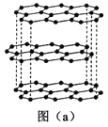
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为_______,原子间存在的共价键类型有________,碳原子的杂化轨道类型为________。
(2)SiCl4分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
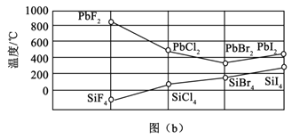
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______。(填“增强”“不变”或“减弱”)
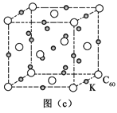
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_________。
【答案】混合型晶体 σ键、π键 sp2 正四面体 非极性 均为分子晶体,范德华力随分子相对质量增大而增大 减弱 K3C60
【解析】
根据晶胞结构判断晶体类型及原子间存在的共价键类型,根据杂化轨道及价电子互斥理论判断分析立体构型与中心原子的杂化方式,利用范德华力的大小解释分子晶体熔沸点的变化规律,根据均摊法确定化合物的化学式。
(1)该单质为石墨,属于混合型晶体,在石墨晶体中,同层的每一个碳原子以sp2杂化轨道与相邻的三个碳原子以σ键结合,六个碳原子在同一个平面上形成了正六边形的环,伸展成片层结构,在同一平面的碳原子还各剩下一个p轨道,其中有一个2p电子。这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键,故答案为:混合型晶体;σ键、π键;sp2;;
(2)SiCl4中心原子是Si,有4个σ键,孤电子对数为![]() ,价层电子对数为4,空间构型为正四面体,该分子中正负中心电荷相互重合,属于非极性分子,故答案为:正四面体;非极性;
,价层电子对数为4,空间构型为正四面体,该分子中正负中心电荷相互重合,属于非极性分子,故答案为:正四面体;非极性;
(3)①SiX4属于分子晶体,不含分子间氢键,范德华力越大,熔沸点越高,范德华力随着相对分子质量的增大而增大,即熔沸点逐渐升高,故答案为:均为分子晶体,范德华力随分子相对质量增大而增大;
②同主族从上到下非金属性减弱,得电子能力减弱,因此PbX2中化学键的离子型减弱,故答案为:减弱;
(4)根据晶胞的结构,C60位于顶点和面心,个数为![]() ,K为与棱上和内部,个数为
,K为与棱上和内部,个数为![]() ,因此化学式为K3C60,故答案为:K3C60。
,因此化学式为K3C60,故答案为:K3C60。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组同学进行乙醛的银镜反应,实验操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。
B.在洗净的试管里配制银氨溶液。
C.沿试管壁加入乙醛稀溶液。
D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是:________________________。
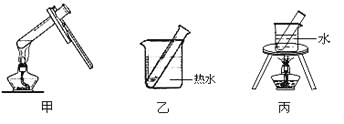
(2)步骤D应选择的加热方法是_________(填下列装置编号)
(3)乙醛发生银镜反应的化学方程式为:_______________________________。
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
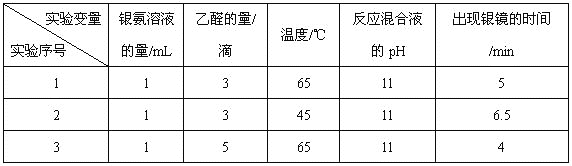
①实验1和实验2,探究的是_________________________________。
②当银氨溶液的量为1 mL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为_________________________min。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以 NA表示阿伏加德罗常数的值,下列说法正确的是
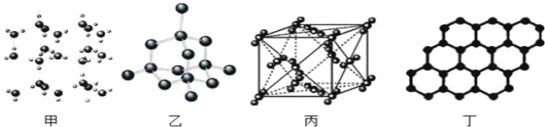
A. 36g冰(图甲)中含共价键数目为4NA
B. 12g金刚石(图乙)中含有σ键数目为4NA
C. 44g干冰(图丙)中含有NA个晶胞结构单元
D. 12g石墨(图丁)中含π键数目3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
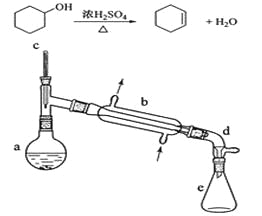
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
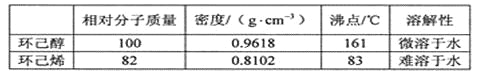
可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是__________________。
(2)加入碎瓷片的作用是_______________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时_____________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________。
(4)分液漏斗在使用前须清洗干净并____________;在本实验分离过程中,产物应该从分液漏斗的_________________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有___________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是____________(填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法正确的是( )
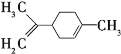
A.分子式为C10H16,其一氯代物有6种
B.分子中所有的碳原子一定在同一平面上
C.和丁基苯(![]() )互为同分异构体
)互为同分异构体
D.一定条件下,可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、砷(As)均为第ⅤA族元素。回答下列问题:
(1)元素周期表中,As位于第_____周期,基态As的价电子排布式为______。与As同周期,基态原子的核外电子排布式中有5个未成对电子的元素是______(写元素符号)。
(2)隔夜的叶菜类熟菜不能食用,原因是其中的部分![]() 在硝酸还原酶作用下转化为致癌的
在硝酸还原酶作用下转化为致癌的![]() 。
。![]() 中N原子的杂化方式为__________________,
中N原子的杂化方式为__________________,![]() 的空间构型是______。
的空间构型是______。
(3)氢氰酸(HCN)可用于制造剧毒的氢氰酸盐毒药,氢氰酸分子的结构式为__________________。
(4)立方氮化硼(BN)质地非常坚硬,是超硬材料,可制成高速切割工具和地质勘探、石油钻探的钻头,其晶胞结构如图所示(黑球为B原子):
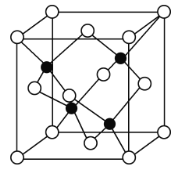
BN晶体中N原子的配位数是______。若阿伏加德罗常数的值为NA,该晶体的密度为ρ g.cm-3,则晶胞边长a=______nm(用含ρ和NA的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机分子中的同分异构现象很普遍,已知乳酸分子存在一对立体(对映)异构体:

对于如下反应:
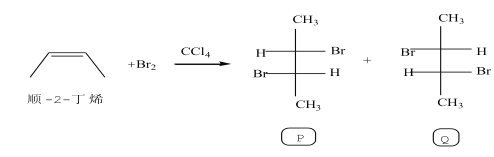
下列判断错误的是
A.上述反应属于加成反应
B.P分子中有2种官能团
C.Q分子中有2个手性碳原子
D.P和Q互为立体异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 0 mol·L-1NH4Cl溶液中逐滴加入0.100 0 mol·L-1KOH溶液时,溶液的pH与KOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
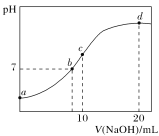
A.点a所示溶液中水的电离程度小于相同温度下纯水的电离程度
B.点b所示溶液中:c(NH4+)=c(K+)=c(H+)=c(OH-)
C.点d所示溶液中的溶质为一水合氨
D.点c所示溶液中:c(K+)+c(H+)=c(NH3·H2O)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com