
����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�
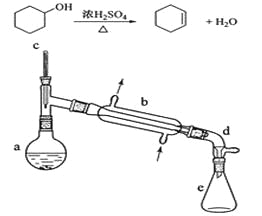
�����õ����й��������£�
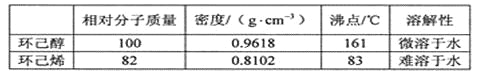
�ϳɷ�Ӧ��
��a�м���20g��������2СƬ���Ƭ����ȴ��������������1 mLŨ���ᡣB��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90����
�����ᴿ��
��Ӧ�ֲ��ﵹ���Һ©���зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ơ�����ͨ������õ���������ϩ10g��
�ش��������⣺
��1��װ��b��������__________________��
��2���������Ƭ��������_______________���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ����ʱ_____________������ȷ�𰸱�ţ���
A���������� B����ȴ�� C�����貹�� D����������
��3����ʵ���������ײ����ĸ�����Ľṹ��ʽΪ_______________________��
��4����Һ©����ʹ��ǰ����ϴ�ɾ���____________���ڱ�ʵ���������У�����Ӧ�ôӷ�Һ©����_________________�������Ͽڵ����������¿ڷų�������
��5�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ����______________________________��
��6���ڻ���ϩ�ֲ�����������У��������õ���������___________������ȷ�𰸱�ţ���
A��Բ����ƿ B���¶ȼ� C������ƿ D������������ E��������
��7����ʵ�����õ��Ļ���ϩ������____________������ȷ�𰸱�ţ���
A��41% B��50% C��61% D��70%
���𰸡�ֱ�������� ��ֹ���� B ![]() ��© �Ͽڵ��� ������ˮ������ CD C
��© �Ͽڵ��� ������ˮ������ CD C
��������
��1��ֱ����������Ҫ����������ʱʹ�ã���������ͷ�����������е㳬��140��ʱ��һ��ʹ�ÿ��������ܣ�����ֱ��������ͨˮ��ȴ���²����²���ը�ѣ�
��2���������Ƭ�������Ƿ�ֹ���У��������һ��ʱ��������ǼӴ�Ƭ��Ӧ����ȴ�ӣ�
��3��2����������Ũ���������·������Ӽ���ˮ������![]() ��
��
��4����Һ©����ʹ��ǰ����ϴ�ɾ�����©���ڱ�ʵ���������У�������ܶȽ�С��Ӧ�ôӷ�Һ©�����Ͽڵ�����
��5����ˮ�Ȼ��ƾ�����ʪ���ã���ʪ����ǿ�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ���Ǹ��
��6���ڻ���ϩ�ֲ�����������У�Ҫ�õ���������Բ����ƿ���¶ȼơ���������
��7������20g�����������ʵ���Ϊ0.2mol�������ɵĻ���ϩ�����ʵ���Ϊ0.2mol������ϩ������Ϊ16.4g��ʵ�ʲ���Ϊ10g��ͨ������ɵû���ϩ������61%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����ѧ��ѧ�����ĵ��ʣ��ס��ҡ���Ϊ��������ڳ��³�ѹ��Ϊ��ɫ��ζ��Һ�壬Ԫ��A�пɱ仯�ϼۡ�����֮���������ͼ����ʾ��ת����ϵ���ɴ��ƶϣ�
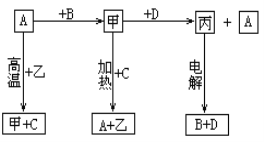
��1���Ļ�ѧʽΪ_____________�����Ļ�ѧʽΪ______________��
��2��д����D��Ӧ�Ļ�ѧ����ʽ___________________________________________��
��3��Ϊ���黯�������Ԫ�صĻ��ϼۣ���Ҫ�õ���ҩƷ��_________________________��
A��ϡ���� B������ C�����軯����Һ D�����������Һ
��4��Ϊ�ⶨA���Ҹ��·�Ӧ�����ù����л����������������ȡ��Ӧ�����ù��岢�������ʵ�飺
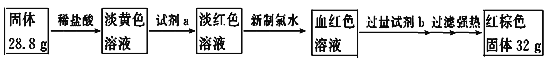
���������������Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2 L�ĺ����ܱ������з�����Ӧ![]() ����Ӧ�����еIJ����������±���ʾ��
����Ӧ�����еIJ����������±���ʾ��
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
����˵����ȷ���ǣ� ��
A.0~5 min��A��ʾ��ƽ����Ӧ����Ϊ![]()
B.�÷�Ӧ��10 min��Ŵﵽƽ��
C.ƽ��״̬ʱ��![]()
D.����B��ƽ��ת����Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���ܹ�����ˮ�ʣ������ǵ�������������ܴ���洦��
��1�� ����[KAl(SO4)2��12H2O]�dz����ľ�ˮ��������ˮ�еĵ��뷽��ʽΪ_______�������ɾ�ˮ����Ϊ����Ȼˮ�����ɽ�״Al(OH)3��Al(OH)3����____�����á�
��2����ʽ�Ȼ���(���BAC)�Ǹ�Ч��ˮ������Ҫ�ɷ֡�ʵ����ģ������������(��Ҫ��Al2O3����������Fe2O3��������������)��ȡ��ʽ�Ȼ���[Al2(OH)nCl6-n]�Ĺ�������:

�������ܽ�����������У�������Ӧ�����ӷ���ʽΪ_____________��_______���ܽ�������費�Ͻ��裬Ŀ����________________��
�����������۵���Ҫ������_______________��
������Ũ�����貣������Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����һԪ��40.8g����������Na��Ӧ�����ɱ�״��������Ϊ4.48L���ô��ɴ���������ȩ�Ľṹ������( )
A.4��B.7��C.8��D.9��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߷��Ӳ���PET������֬��PMMA�ĺϳ�·�����£�
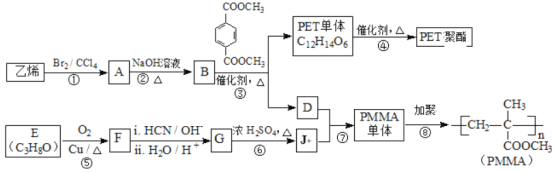
��֪����.RCOOR��+ R���18OH![]() RCO18OR���+ R��OH��R��R�䡢R��������������
RCO18OR���+ R��OH��R��R�䡢R��������������
��.![]()
![]()
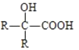 ��R��R�������������
��R��R�������������
��1���ٵķ�Ӧ������______��
��2���ڵĻ�ѧ����ʽΪ______��
��3��PMMA���������������______��______��
��4��F�ĺ˴Ź���������ʾֻ��һ��壬�ݵĻ�ѧ����ʽΪ______��
��5��G�Ľṹ��ʽΪ______��
��6������˵����ȷ����______������ĸ��ţ���
a.��Ϊ������Ӧ
b.B��D��Ϊͬϵ��
c.D�ķе��̼ͬԭ������������
d.1 mol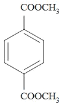 ������NaOH��Һ��Ӧʱ���������4 molNaOH
������NaOH��Һ��Ӧʱ���������4 molNaOH
��7��J��ij��ͬ���칹����J������ͬ�����ţ���Ϊ˳ʽ�ṹ����ṹ��ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ͱ���һ���������ʣ��ᴫ���˷ܼ����ĵ���Ϣ���䲿�ֺϳ�·�����£�����˵����ȷ����

A. ���ڱ����ϵ����������2��
B. lmol����H2�����ӳɣ��������3molH2
C. ��Ͱ�����������̼ԭ�ӿ��ܴ���ͬһƽ��
D. �ס��ҡ���Ͱ�3�����ʾ����ڷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ���ƿ�У���25��ʱ��������ƽ�⣺2NO2(g)![]() N2O4(g) ��H<0������ƿ����100���ˮ�У������м��������в���ı���ǣ� ��
N2O4(g) ��H<0������ƿ����100���ˮ�У������м��������в���ı���ǣ� ��
����ɫ ��ƽ����Է������� ������ ��ѹǿ ���ܶ�
A.�ٺ͢�B.�ۺ͢�
C.�ܺ͢�D.�ں͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ����
A.��̬�⻯����ȶ��ԣ�H2O��NH3
B.��Ԫ��������Ԫ�ؿ��γɹ��ۻ���������ӻ�����
C.��ͼ��ʾʵ���֤��Ԫ�صķǽ����ԣ�Cl��C��Si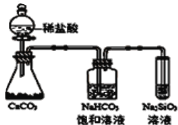
D.�˹��ϳɵĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com