
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%
【答案】C
【解析】
A.v(C)= ,同一反应反应中反应速率之比等于计量数之比,3v(A)=v(C),所以v(A)=
,同一反应反应中反应速率之比等于计量数之比,3v(A)=v(C),所以v(A)=![]() ,故A错误;
,故A错误;
B.15min时,n(B)=1.6mol,消耗了2.4mol-1.6mol=0.8mol,根据方程式可知这段时间内消耗A的物质的量为0.4mol,所以15min时,n(A)=1.6mol,与10min时A的物质的量相同,说明10~15min这段时间内平衡没有移动,但无法确定是10min时达到平衡,还是10min前已经达到平衡,故B错误;
C.根据B选项分析可知平衡时消耗的B为0.8mol,根据方程式可知生成C的物质的量为1.2mol,浓度为![]() ,故C正确;
,故C正确;
D. 物质B的平衡转化率为![]() ,故D错误;
,故D错误;
故答案为C。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列物质中氧原子数目与6.8gH2O2中氧原子数目一定相等的是( )
A.6.72 L COB.6.6 g CO2C.8 g SO3D.9.8 g H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
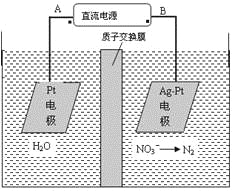
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是![]()
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5m的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() 的溶液不一定呈碱性
的溶液不一定呈碱性
B.中和pH和体积均相等的氨水、![]() 溶液,所需
溶液,所需![]() 的物质的量相同
的物质的量相同
C.相同温度下,pH相等的盐酸、![]() 溶液中,
溶液中,![]() 相等
相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种广泛使用的高分子材料助剂的结构简式,下列说法正确的是( )(CH3CH2CH2CH3可表示为![]()
![]()

A.该有机物的分子式为C24H40O4
B.1mol该有机物与氢气发生加成反应,最多消耗5mol氢气
C.该有机物在氢氧化钠作用下发生水解反应得到三种有机物
D.该有机物在FeBr3存在下与液溴发生取代反应生成两种一溴代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
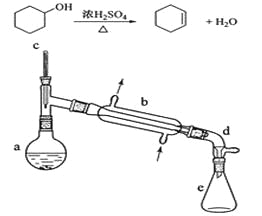
可能用到的有关数据如下:
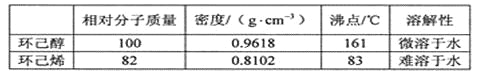
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是__________________。
(2)加入碎瓷片的作用是_______________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时_____________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________。
(4)分液漏斗在使用前须清洗干净并____________;在本实验分离过程中,产物应该从分液漏斗的_________________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有___________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是____________(填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)工业上,可用次氯酸钠与氨反应制备N2H4(肼),副产物对环境友好,写出反应的化学方程式________。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:

①该反应的ΔH_____0(填“>”或“<”)。
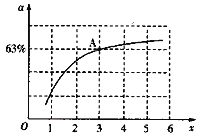
②已知原料气中的氨碳比[![]() ]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
(3)①在氨水加水稀释的过程中,NH3·H2O的电离程度增大,![]() 的值_______。(填“增大”、“减小”或“不变”,)
的值_______。(填“增大”、“减小”或“不变”,)
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是_____(用离子方程式表示),该反应的平衡常数为______(用含a的数学表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com