
【题目】下列实验方案不能达到预期目的的是
实验方案 | 实验目的 | |
A | 向两支试管中分别加入 | 探究 |
B | 取 | 配制8%的 |
C | 将 | 比较 |
D | 测同温同浓度 | 比较硫和硅两元素非金属性强弱 |
A.AB.BC.CD.D
【答案】A
【解析】
A.向两支试管中分别加入2mL5%H2O2溶液,然后只向其中一支试管中加入绿豆大小的FeI2固体,FeI2与H2O2会发生氧化还原反应,且生成的Fe3+也可以催化H2O2的分解,故不能用来探究I-对H2O2分解反应的催化作用, A 错误。
B.取8gNaOH固体加入到92mL水中(的密度近似看作1g/mL),所得溶液的质量百分含量为:![]() ,故B正确;
,故B正确;
C.将ZnSO4溶液滴入盛有2mLNa2S溶液的试管中至不再产生沉淀,然后滴入相同浓度的CuSO4溶液,可以观察到沉淀由白色转化为黑色,且ZnS(白色)和CuS(黑色)相同类型的物质,故可以据此来比较溶度积常数属性强弱,C正确;
D.测同温同浓度Na2SO4和Na2SiO3水溶液的PH,Na2SO4溶液呈中性,说明Na2SO4是强酸强碱盐,而Na2SiO3溶液呈碱性,说明Na2SiO3为强碱弱酸盐,即H2SO4为强酸,H2SiO3为弱酸,故比较硫和硅两元素非金属性强弱,D正确;
故答案为:A。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】三大化石燃料燃烧会产生大气污染物,特别是含硫煤燃烧后产生的SO2危害巨大。为了保护环境,科学家提出了下列解决方法,同时还能获得某种重要的工业产品。下列说法错误的是

A.不用O2直接氧化SO2是因为氧化速率太慢
B.图中涉及的反应之一为4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O
C.反应一段时间后,溶液中Fe2(SO4)3的浓度会减小
D.理论上每吸收标况下224mL SO2可以获得0.98gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别为A、B、C、D四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH与A、C、D的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是( )
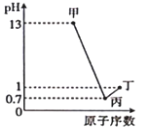
A.简单离子半径: D>C>B>A
B.A、C形成的化合物水溶液呈碱性
C.C、D形成的氢化物稳定性:C>D
D.A、B分别与D形成的化合物均为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素N、S、![]() 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知![]() 的结构为
的结构为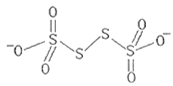 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发的对二甲苯合成流程如图所示。下列说法正确的是( )
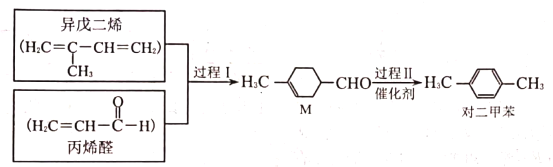
A.过程Ⅰ发生的是取代反应
B.可用溴水鉴别![]() 和对二甲苯
和对二甲苯
C.对二甲苯的密度比水大
D.![]() 的某种同分异构体含有苯环且能与钠反应放出氢气
的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
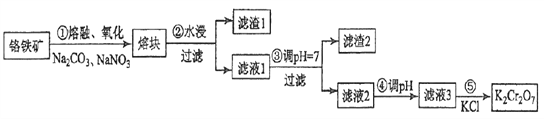
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_________。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_________。
(2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。
(3)步骤④调滤液2的pH使之变______(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
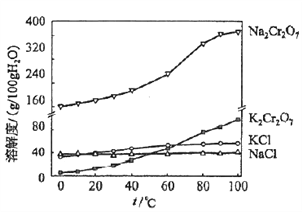
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生活中常见的有机物之一,不仅是食醋的主要成分,在工业上也可用于制氢,已知如下反应:
热裂解反应:![]()
![]()
脱羧基反应:![]()
![]()
合成乙酸反应:![]()
![]()
(1)请写出![]() 与
与![]() 甲醇化的热化学方程式________。
甲醇化的热化学方程式________。
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为________。
a.较低温度 b.较大压强 c.高温 d.低压
(3)向一恒容密闭容器充入一定量的乙酸气体发生反应,相同时间后,测得温度与气体产率的关系如图:
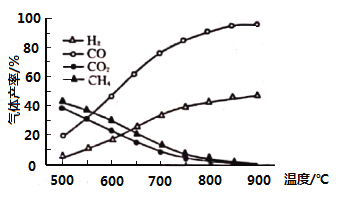
①约![]() 之前氢气产率低于甲烷的可能原因是________。而
之前氢气产率低于甲烷的可能原因是________。而![]() 之后氢气产率高于甲烷的理由是________。
之后氢气产率高于甲烷的理由是________。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而![]() 产率下降,原因是________(用化学方程式表示)。
产率下降,原因是________(用化学方程式表示)。
(4)温度为![]() 时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为
时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,乙酸的体积分数为________;脱羧基反应的平衡常数
,乙酸的体积分数为________;脱羧基反应的平衡常数![]() =________
=________![]() (
(![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Kx[Cu(C2O4)y]·zH2O (水合草酸铜(Ⅱ)酸钾)是一种化工原料,实验室制备少量水合草酸铜酸钾并测定样品的组成,实验步骤如下:
I制备CuO
用图1所示装置将溶液混合后,小火加热至蓝色沉淀变黑色生成CuO,煮沸5~10分钟。稍冷却后全部转移至图2装置过滤,并用蒸馏水洗涤沉淀2~3次。
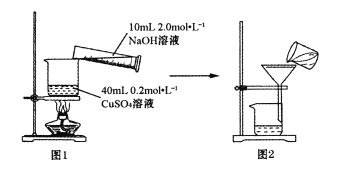
(1)①指出图2装置中操作中的错误___________,图2操作需用蒸馏水洗涤沉淀2~3次,其目为___________。
②检验沉淀洗涤干净的方法为___________。
Ⅱ制备KHC2O4和K2C2O4混合溶液
称取3.0g H2C2O4·2H2O放入250mL烧杯中,加入40mL蒸馏水,微热(温度低于80℃)溶解。稍冷后分数次加入2.2g无水K2CO3,充分反应后生成含KHC2O4和K2C2O4的混合物。
(2)该步骤中所得混合物中n(KHC2O4):n(K2C2O4)=____________。(取整数)
Ⅲ制备水合草酸铜酸钾晶体
将KHC2O4和K2C2O4混合溶液水浴微热,再将CuO连同滤纸一起加入到该溶液中,充分反应至CuO沉淀全部溶解,取出滤纸后,加热浓缩、冷却结晶、过滤,用乙醇淋洗,自然晾干,称量得到样品2.9760g(电子天平称量)。
(3)①步骤Ⅲ中KHC2O4的作用是__________。
②用乙醇淋洗而不用水的优点是__________。
③溶解CuO沉淀时,连同滤纸一起加人到溶液中的目的是__________。
Ⅳ测定水合草酸铜酸钾晶体的成分
取少量制得的样品配成溶液。用标准酸性髙锰酸钾溶液滴定![]() 、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(
、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(![]() )=1:2,假设制备样品的过程中Cu2+无损耗。
)=1:2,假设制备样品的过程中Cu2+无损耗。
(4)水合草酸铜(Ⅱ)酸钾晶体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂。下列关于“对氨基苯甲酸丁酯”的说法中正确的是( )
A.它的分子式为C11H15NO2
B.它能与盐酸反应,但不能与苛性钠溶液反应
C.甲酸丁酯基(—COOC4H9)有3种同分异构体
D.从有机物分类看,它可属于氨基酸类、酯类、芳香类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com