
【题目】乙酸是生活中常见的有机物之一,不仅是食醋的主要成分,在工业上也可用于制氢,已知如下反应:
热裂解反应:![]()
![]()
脱羧基反应:![]()
![]()
合成乙酸反应:![]()
![]()
(1)请写出![]() 与
与![]() 甲醇化的热化学方程式________。
甲醇化的热化学方程式________。
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为________。
a.较低温度 b.较大压强 c.高温 d.低压
(3)向一恒容密闭容器充入一定量的乙酸气体发生反应,相同时间后,测得温度与气体产率的关系如图:
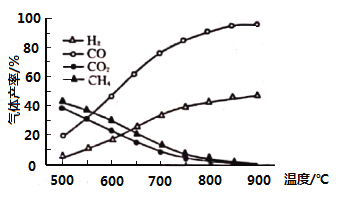
①约![]() 之前氢气产率低于甲烷的可能原因是________。而
之前氢气产率低于甲烷的可能原因是________。而![]() 之后氢气产率高于甲烷的理由是________。
之后氢气产率高于甲烷的理由是________。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而![]() 产率下降,原因是________(用化学方程式表示)。
产率下降,原因是________(用化学方程式表示)。
(4)温度为![]() 时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为
时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,乙酸的体积分数为________;脱羧基反应的平衡常数
,乙酸的体积分数为________;脱羧基反应的平衡常数![]() =________
=________![]() (
(![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
【答案】![]()
![]() ad 脱羧基反应活化能低, 反应速率快 随着温度升高后, 热裂解反应速率加快, 同时热裂解反应正向移动, 而脱羧基反应逆向移动, 故氢气产率高于甲烷( 合理即可)
ad 脱羧基反应活化能低, 反应速率快 随着温度升高后, 热裂解反应速率加快, 同时热裂解反应正向移动, 而脱羧基反应逆向移动, 故氢气产率高于甲烷( 合理即可) ![]()
![]()
![]()
【解析】
(1)根据盖斯定律书写热化学方程式;
(2)根据影响化学平衡的因素分析;
(3)根据影响化学反应速率和化学平衡移动的因素分析;
(4)根据阿伏加德罗定律:压强之比等于物质的量之比进行解答。
(1)由反应①![]()
![]() ;
;
②![]()
![]() ;
;
③![]()
![]()
根据盖斯定律,可知:①+③CH3OH![]() CO(g)+2H2(g)
CO(g)+2H2(g)![]() H=+90.0kJ/mol,所以
H=+90.0kJ/mol,所以![]() 与
与![]() 甲醇化的热化学方程式
甲醇化的热化学方程式![]()
![]() ,故答案:
,故答案:![]()
![]() ;
;
(2)根据脱羧基反应:![]()
![]() 可知:脱羧基反应是一个气体体积增大的放热反应,所以要使甲烷产率较高,应控制较低温度和较低压强,故答案:ad;
可知:脱羧基反应是一个气体体积增大的放热反应,所以要使甲烷产率较高,应控制较低温度和较低压强,故答案:ad;
(3)①由已知热裂解反应:![]()
![]() ;脱羧基反应:
;脱羧基反应:![]()
![]() 可知,
可知,![]() 之前,氢气产率低于甲烷,可能原因是脱羧基反应为放热反应,活化能低,反应速率快;而之后随温度升高后,热裂解反应是吸热反应,热裂解反应速率加快,同时热裂解反应正向移动,脱羧基反应逆向移动,故氢气产率会高于甲烷,故答案:脱羧基反应活化能低,反应速率快;
之前,氢气产率低于甲烷,可能原因是脱羧基反应为放热反应,活化能低,反应速率快;而之后随温度升高后,热裂解反应是吸热反应,热裂解反应速率加快,同时热裂解反应正向移动,脱羧基反应逆向移动,故氢气产率会高于甲烷,故答案:脱羧基反应活化能低,反应速率快;
随着温度升高后,热裂解反应速率加快,同时热裂解反应正向移动,而脱羧基反应逆向移动,故氢气产率高于甲烷;
②在乙酸气体中掺杂水蒸气可发生反应![]() ,所以
,所以![]() 产率下降而
产率下降而![]() 产率提高,故答案:
产率提高,故答案:![]() ;
;
(4)根据已知:密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,设充入乙酸的物质的量为
,设充入乙酸的物质的量为![]() , 达平衡时各物质的物质的量为:
, 达平衡时各物质的物质的量为:
脱羧基反应:![]()
反应消耗 ![]()
达平衡时 ![]()
![]()
热裂解反应: ![]()
反应消耗 ![]()
达平衡时 ![]()
![]()
反应后总物质的量为 ![]()
乙酸的体积分数为![]() ,脱羧基反应
,脱羧基反应![]() 的气体分压为
的气体分压为![]() ,
, 。故答案:
。故答案:![]() ;
;![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,[H+]和[OH-]的关系如图所示:
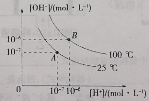
(1)A点水的离子积常数____(填“>”、“=”或“<”)B点水的离子积常数,造成水的离子积常数变化的原因是____。
(2)25℃时,若向水中滴加稀硫酸,___(填“能”或“不能”)使体系处于A点状态,原因是___。
(3)100℃时,若稀硫酸中由水电离产生的[H+]=1×10-8 mol·L-1,则稀硫酸的pH=_____,用pH试纸测定溶液的pH时,正确操作是____。
(4)100℃时将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1:V2=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是甲、乙、丙、丁四种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成丙; ③比例模型为 |
乙 | ①由C、H两种元素组成; ②比例模型为 |
丙 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与丁反应生成相对分子质量为100的酯 |
丁 | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应的生成物的结构简式是__。
(2)乙具有的性质是__(填序号)。
A.无色无味液体,有毒
B.不溶于水,密度比水的大
C.不能使酸性KMnO4溶液褪色
D.任何条件下不与氢气反应
(3)丙的官能团的名称:__;写出丙与Na反应的化学方程式:__。
(4)甲与氢气发生加成反应后生成物质戊,与戊在结构上相似的有机物有一大类(即“同系物”),它们均符合通式CnH2n+2。当n≥__时,这类有机物出现同分异构现象。
(5)丙与丁反应能生成相对分子质量为100的酯,该反应的反应类型为__;其化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到预期目的的是
实验方案 | 实验目的 | |
A | 向两支试管中分别加入 | 探究 |
B | 取 | 配制8%的 |
C | 将 | 比较 |
D | 测同温同浓度 | 比较硫和硅两元素非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是重要的战略物资,2016年我国江西省发现超大型钨矿,再次刷新钨矿储量的世界纪录。由钨铁矿(主要成分是![]() ,还含有少量
,还含有少量![]() )制取钨的工业流程如下(已知:常温下,钨酸难溶于水)。
)制取钨的工业流程如下(已知:常温下,钨酸难溶于水)。
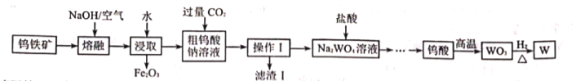
请回答下列有关问题:
(1)浸取后进行的分离操作的名称是________。
(2)滤渣![]() 的主要成分是________(填化学式),写出生成该物质的离子方程式________。
的主要成分是________(填化学式),写出生成该物质的离子方程式________。
(3)已知![]() 中铁元素的化合价为+2价,
中铁元素的化合价为+2价,![]() 在熔融过程中发生反应的化学方程式为________。
在熔融过程中发生反应的化学方程式为________。
(4)在![]() 溶液中加入盐酸时,为了防止局部酸度过大,应采取的措施是________。
溶液中加入盐酸时,为了防止局部酸度过大,应采取的措施是________。
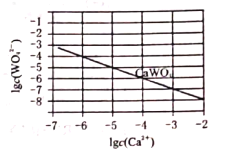
(5)如图为![]() 在常温下的沉淀溶解平衡曲线,若将
在常温下的沉淀溶解平衡曲线,若将![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液按体积比2:1混合,要产生
溶液按体积比2:1混合,要产生![]() 沉淀,则
沉淀,则![]() ________。(忽略溶液体积变化)
________。(忽略溶液体积变化)
(6)用碳化钨![]() 作阳极,不锈钢作阴极,
作阳极,不锈钢作阴极,![]() 溶液作电解液,通过电解可以回收钨,电解后阳极上析出钨酸并放出
溶液作电解液,通过电解可以回收钨,电解后阳极上析出钨酸并放出![]() ,则阳极反应式为________;若在标准状况下放出
,则阳极反应式为________;若在标准状况下放出![]() ,则阳极增重的质量为________
,则阳极增重的质量为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体的晶胞结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )

A. 1∶4∶2 B. 3∶9∶4
C. 2∶9∶4 D. 3∶8∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者最近研发一种新型铝—石墨烯电池,其负极是金属铝,正极是石墨烯(Cn)薄膜,电解质为阳离子(EMI+)与阴离子(![]() )组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
)组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
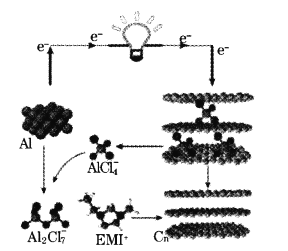
A.该铝电极电池比锂电极电池的能量密度低
B.石墨烯电极的比表面积大,充放电性能优于石墨电极
C.充电时,有机阳离子(EMI+)向铝电极移动
D.放电时,负极的电极反应式为2Al+7Clˉ-6eˉ=Al2Cl![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL 0.2 mol/L的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )

A.A点对应的I2的物质的量为1.0×10-3 mol
B.oa : ab = 4 : 1
C.当溶液中的n(I2) = 5×10-4 mol时,加入NaHSO3的物质的量可能为2.5×10-3 mol或5.5×10-3 mol
D.由ab段反应可知,氧化性I2 >![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式是![]() ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B.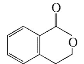 C.
C.![]() D.
D.![]() 。
。
(1)有机物A分别与足量的Na、NaOH、NaHCO3反应时,消耗三者物质的量之比为___。
(2)写出B的分子式___。
(3)写出由A制取C的化学方程式___,反应类型___。
(4)由D也可以制取C,写出有关反应的方程式___。
(5)具备以下条件A的同分异构体有___种。
①能水解且能发生银镜反应
②遇三氯化铁溶液显色
③苯环上有三个取代基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com