
【题目】有机物A的结构简式是![]() ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B.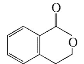 C.
C.![]() D.
D.![]() 。
。
(1)有机物A分别与足量的Na、NaOH、NaHCO3反应时,消耗三者物质的量之比为___。
(2)写出B的分子式___。
(3)写出由A制取C的化学方程式___,反应类型___。
(4)由D也可以制取C,写出有关反应的方程式___。
(5)具备以下条件A的同分异构体有___种。
①能水解且能发生银镜反应
②遇三氯化铁溶液显色
③苯环上有三个取代基
【答案】2:1:1 C9H8O2 ![]()
![]()
![]() +H2O 消去反应
+H2O 消去反应 ![]() +2NaOH
+2NaOH![]()
![]() +NaBr+2H2O、
+NaBr+2H2O、![]() +HCl→
+HCl→![]() +NaCl 20
+NaCl 20
【解析】
(1) ![]() 中含有羧基、醇羟基,羧基和Na、NaOH、NaHCO3都能反应,醇羟基只与Na反应,
中含有羧基、醇羟基,羧基和Na、NaOH、NaHCO3都能反应,醇羟基只与Na反应,![]() 分别与足量的Na、NaOH、NaHCO3反应时,消耗三者物质的量之比为2:1:1;
分别与足量的Na、NaOH、NaHCO3反应时,消耗三者物质的量之比为2:1:1;
(2) B的结构简式是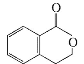 ,分子式是C9H8O2;
,分子式是C9H8O2;
(3) ![]() 在浓硫酸作用下发生消去反应生成
在浓硫酸作用下发生消去反应生成![]() ,反应方程式是是
,反应方程式是是![]()
![]()
![]() +H2O;
+H2O;
(4) ![]() 在氢氧化钠的醇溶液中发生反应生成
在氢氧化钠的醇溶液中发生反应生成![]() ,
,![]() 酸化生成
酸化生成![]() ,反应方程式是
,反应方程式是![]() +2NaOH
+2NaOH![]()
![]() +NaBr+2H2O、
+NaBr+2H2O、![]() +HCl→
+HCl→![]() +NaCl;
+NaCl;
(5)![]() 的同分异构体,遇三氯化铁溶液显色,说明含有酚羟基;能水解且能发生银镜反应说明含有甲酸酯基,苯环上有三个取代基,同时符合要求的3个取代基是-OH、-CH2CH3、HCOO-或-OH、-CH3、HCOOCH2-,每种组合在苯环上的位置有10种,共20种;
的同分异构体,遇三氯化铁溶液显色,说明含有酚羟基;能水解且能发生银镜反应说明含有甲酸酯基,苯环上有三个取代基,同时符合要求的3个取代基是-OH、-CH2CH3、HCOO-或-OH、-CH3、HCOOCH2-,每种组合在苯环上的位置有10种,共20种;


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】乙酸是生活中常见的有机物之一,不仅是食醋的主要成分,在工业上也可用于制氢,已知如下反应:
热裂解反应:![]()
![]()
脱羧基反应:![]()
![]()
合成乙酸反应:![]()
![]()
(1)请写出![]() 与
与![]() 甲醇化的热化学方程式________。
甲醇化的热化学方程式________。
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为________。
a.较低温度 b.较大压强 c.高温 d.低压
(3)向一恒容密闭容器充入一定量的乙酸气体发生反应,相同时间后,测得温度与气体产率的关系如图:
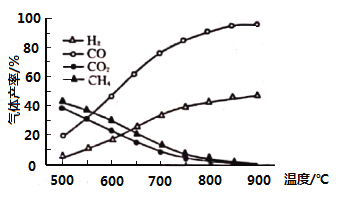
①约![]() 之前氢气产率低于甲烷的可能原因是________。而
之前氢气产率低于甲烷的可能原因是________。而![]() 之后氢气产率高于甲烷的理由是________。
之后氢气产率高于甲烷的理由是________。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而![]() 产率下降,原因是________(用化学方程式表示)。
产率下降,原因是________(用化学方程式表示)。
(4)温度为![]() 时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为
时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,乙酸的体积分数为________;脱羧基反应的平衡常数
,乙酸的体积分数为________;脱羧基反应的平衡常数![]() =________
=________![]() (
(![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A.金属发生电化学腐蚀的正极反应式:M-ne-=Mn+
B.家用小苏打溶于水后的电离:NaHCO3=Na++H++CO![]()
C.氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+H+
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s)+CO![]() (aq)CaCO3(s)+SO
(aq)CaCO3(s)+SO![]() (aq)
(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂。下列关于“对氨基苯甲酸丁酯”的说法中正确的是( )
A.它的分子式为C11H15NO2
B.它能与盐酸反应,但不能与苛性钠溶液反应
C.甲酸丁酯基(—COOC4H9)有3种同分异构体
D.从有机物分类看,它可属于氨基酸类、酯类、芳香类
查看答案和解析>>
科目:高中化学 来源: 题型:
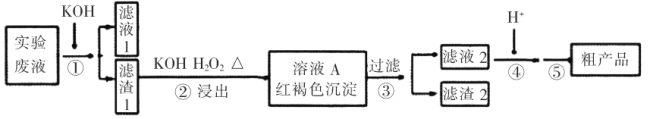
【题目】某实验室废液含![]() 等离子,现通过如下流程变废为宝制备
等离子,现通过如下流程变废为宝制备![]() 。
。
已知:(a)![]()
![]() (黄色)
(黄色)
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
沉淀 | 沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
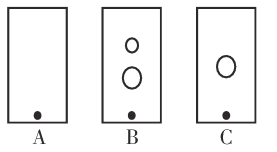
请回答:
(1)如在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是:_________________。
(2)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的点如图所示。加入KOH最适合的实验编号是(上图ABC中选择,实验顺序已乱)_________________,C的斑点颜色为_________________。
(3)步骤②含Cr物质发生的主要反应的离子方程式为_________________。
(4)在下列装置中,步骤②应选用实验装置是_________________。(填标号)
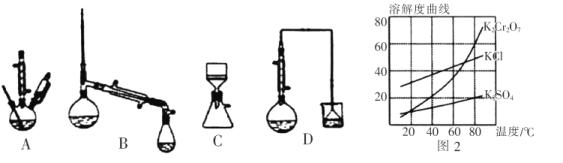
(5)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c.蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序_________________。
(6)步骤⑤中合适的洗涤剂是_________________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”),粗产品进一步提纯的方法是_________________。
(7)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol.L-1的![]() 标准溶液滴定(杂质不反应),消耗标准
标准溶液滴定(杂质不反应),消耗标准![]() 溶液VmL,则该粗产品中
溶液VmL,则该粗产品中![]() 的纯度为_________________。(
的纯度为_________________。(![]() 的式量:294)
的式量:294)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。请回答下列问题:
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
(1)基态B原子的价电子排布式为_____,B、C、N、O第一电离能由大到小的顺序为_____,CH4、NH3、CO2的键角按照由大到小的顺序排列为_____。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。
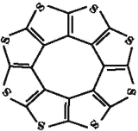
①S的基态原子中能量最高的电子,其原子轨道呈_____形。
②C16S8与H2微粒间的作用力是_____。
③C16S8分子中C原子和S原子的杂化轨道类型分别为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种重要的化工原料,它可由石油和煤焦油通过下列路线合成:
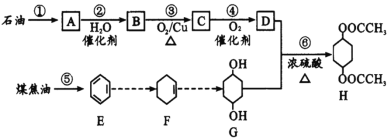
(1)A的名称是____;过程①是____变化(填“物理”或“化学”,下同),过程⑤是_______变化。
(2)反应③的化学方程式为_______;反应⑥的类型为_________。
(3)鉴别E与F的方法是_________________。
(4)H中六元环上的氢原子被两个氯原子取代后的有机物有___种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com